製品Q&Aご使用にあたり
本Q&Aは、医療従事者向けの内容で、医療従事者が患者に対して行う診断、指導、助言等に代替するものではありません。また、掲載している情報は、医療従事者が製品の適正な使用を行うための一般的情報または参考情報であり、全ての症例またはケースに適応するものではありません。従いまして、本Q&Aのご利用によって生じた結果については、責任を負いかねますのでご了承ください。
本Q&Aには、承認外の内容(用法・用量、適応、剤形等)が含まれている場合がありますので、ご注意ください。製品のご使用に当たっては、最新の電子添文をご確認くださいますようお願いいたします。
なお、本Q&Aを許可なく複写、複製、転掲、頒布、改変等を行うことはご遠慮ください。
用法・用量
-
ディナゲストを初めて服用する場合、なぜ月経周期2~5日目から開始するのですか?
妊婦又は妊娠している可能性のある方は禁忌であることから、投与開始にあたっては、妊娠していないことを確認することが必要であり、そのために「月経周期2~5日目より経口投与する」としました。
電子添文抜粋
6. 用法及び用量
通常、成人にはジエノゲストとして1日2mgを2回に分け、月経周期2~5日目より経口投与する。
7. 用法及び用量に関連する注意
治療に際しては妊娠していないことを確認し、必ず月経周期2~5日目より投与を開始すること。また、治療期間中は非ホルモン性の避妊をさせること。[2.2、9.5 参照]
2025年12月改訂
-
ディナゲストを飲み忘れた時はどうすればいいですか?
一般の医療用医薬品と同じです。
飲み忘れた場合は、忘れた分を気がついた時にできるだけ早く飲ませてください。ただし、次に通常服用する時間が近い場合は飲まずに、次の服用時間から1回分を飲ませてください。2回分を一度に飲まないようにさせてください。2017年9月作成
治療
-
ディナゲスト服薬終了から何日後に次の月経がきますか?
個人差がありますが、約1カ月後です。
投与終了後から再来月経までの日数
子宮内膜症患者を対象とした長期試験では27.5(24.5:32.0)日(中央値(25%点:75%点))でした1)。
子宮腺筋症患者を対象とした長期試験では27.0(24.0:32.0)日(中央値(25%点:75%点))でした2)。
なお、子宮内膜症の製造販売後調査の結果では43.0(29.0:77.5)日(中央値(25%点:75%点))でした3)。【参考資料】
1) 持田製薬社内資料:長期投与試験-子宮内膜症患者における長期投与の有効性および安全性の検討-(2007年10月19日承認、CTD 2.7.6.8)
2) 持田製薬社内資料:子宮腺筋症患者を対象とした長期投与試験(2016年12月2日承認、CTD 2.7.6.2.1)
3) 足立 勇博, 他. Therapeutic Research 2019; 40: 135-502025年12月改訂
-
ディナゲストの使用に際しての指導用の冊子等はありますか?
下記の診療サポート資材を作成しておりますので担当MRにお申し付けください。
【主な患者用冊子】
- ディナゲスト錠1mgを服用される患者さんへ よくわかる子宮内膜症‐病態と治療-[製作物コード:13857]
- ディナゲスト錠1mgを服用される患者さんへ よくわかる子宮腺筋症‐病態と治療-[製作物コード:14484]
- My Diary[製作物コード:14483]
【主な医療機関用冊子】
- LECTURE BOARD[製作物コード:13856]
- ディナゲスト錠を服用中の患者さまへ このような出血症状はありませんか?[製作物コード:11903]
【適正使用情報】
- 適正使用のお願い ディナゲスト錠1mg・OD錠1mgをより安全にお使い頂くために
2025年12月改訂
特殊患者
-
ディナゲストを妊婦に投与できますか?
妊婦又は妊娠している可能性のある方は禁忌ですので服用させないでください。ラットおよびウサギを用いた生殖発生毒性試験では、催奇形作用は認められませんでした。しかし、親世代動物において受胎阻害、流産および妊娠期間の延長、次世代動物においては着床前および着床後胚死亡率の増加、生殖能障害などが認められています1)。
電子添文抜粋
2. 禁忌(次の患者には投与しないこと)
2.2 妊婦又は妊娠している可能性のある女性[7.、9.5 参照]
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。動物実験(ラット、ウサギ)において、受胎阻害、胚死亡率の増加及び流産等が認められている。[2.2、7. 参照]
【参考資料】
1) インタビューフォーム Ⅸ. 非臨床試験に関する項目 2. 毒性試験 (5)生殖発生毒性試験2025年12月改訂
-
ディナゲストを授乳婦に投与できますか?
授乳婦に対する臨床試験は実施しておらず、安全性が確立していないことから、ディナゲストを服用する場合は授乳させないことが望ましいです。
【参考】動物データ(ラット)
分娩後10日目の雌性ラット(Wistar系、1群3例)に、[14C]ジエノゲストを1mg/kg単回経口投与したときの乳汁および血漿中放射能濃度を測定しました。いずれの測定時間においても、乳汁中の放射能濃度は、母獣血漿中の放射能とほぼ同程度であり、投与後0.75時間に最高値295.1ng eq./mLを示した後、投与72時間後には最高値の1%に低下し、血漿中からの放射能の消失に伴って乳汁中からも消失することが確認されました1)。電子添文抜粋
9. 特定の背景を有する患者に関する注意
9.6 授乳婦
授乳しないことが望ましい。動物実験(ラット)において、乳汁中に移行することが報告されている。
【参考資料】
1) インタビューフォーム Ⅶ. 薬物動態に関する項目 5. 分布 (3)乳汁への移行性2025年12月改訂
-
ディナゲストは、なぜ、「高度の子宮腫大又は重度の貧血のある患者」が禁忌なのですか?
子宮内膜症の承認以降(国内市販後)に集積された重篤な不正子宮出血・貧血を発現した症例において「高度の子宮腫大」あるいは「重度の貧血」を有する患者が認められました。そのため、子宮腺筋症患者を対象とした国内臨床試験では、被験者の安全性を考慮し、「高度の子宮腫大を有する患者」および「重度の貧血の合併を有する患者」を除外(注1)しました。その結果、重篤な不正子宮出血・貧血の副作用は認められませんでした1)、2)。
この結果を踏まえ、重篤な不正子宮出血・貧血の発現リスクを軽減するため、「高度の子宮腫大又は重度の貧血のある患者」を「禁忌」に設定しました。注1: 子宮腺筋症患者を対象とした国内臨床試験時の「高度の子宮腫大を有する患者」および「重度の貧血の合併を有する患者」の除外基準
【子宮の大きさ】
- 子宮体部の最大径10cm以上(子宮頚部は含めない)あるいは子宮筋層最大厚4cm以上(筋層の最も厚い部分)
【貧血の程度】
- ヘモグロビン値8.0g/dL未満
電子添文抜粋
2. 禁忌(次の患者には投与しないこと)
2.4 高度の子宮腫大又は重度の貧血のある患者[不正子宮出血が増悪し、大量出血を起こすおそれがある。][8.4、11.1.1、17.1.3、17.1.4 参照]
【参考資料】
1) インタビューフォーム Ⅴ. 治療に関する項目 5. 臨床成績<子宮腺筋症に伴う疼痛の改善> (4)検証的試験
2)安全性試験 第Ⅲ相長期投与試験
2) インタビューフォーム Ⅷ. 安全性(使用上の注意等)に関する項目 2. 禁忌内容とその理由2025年12月改訂
-
ディナゲストを10代の患者に投与できますか?
最大骨塩量に達していない患者につきましては、ディナゲストの投与による骨密度の減少の可能性や将来的な骨粗鬆症等の発症リスクを考慮した上で、投与の可否を慎重に判断してください。
12~18歳の子宮内膜症患者を対象とした海外提携会社が実施した海外臨床試験1)において、ジエノゲスト(2mg /日)投与終了時(52週時または52週未満の投与終了時)の腰椎の骨密度平均変化率±標準偏差は-1.2%±2.3%(n=103)でした。投与終了までに103例中73例の骨密度が低下し、その平均変化率は-2.3%でしたが、投与中止後、再度骨密度の増加が観察されました。
なお、子宮内膜症患者および子宮腺筋症患者を対象とした国内臨床試験は、いずれの試験も「選択基準:20歳以上」のため、ディナゲストの10代の患者への投与経験はありませんでした。
電子添文抜粋
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.3 最大骨塩量に達していない患者
本剤投与に際し、本剤投与による骨密度の減少の可能性や将来的な骨粗鬆症等の発症リスクを考慮した上で、本剤の投与の可否を慎重に判断すること。また、本剤投与中は、定期的に骨塩量検査を実施するなど患者の状態に十分注意し、治療上の有益性と骨密度減少のリスクを考慮した上で投与継続の可否を慎重に判断し、漫然と投与しないこと。12歳~18歳を対象とした海外臨床試験において、本剤52週間投与後の骨密度変化率は-1.2%であった。[9.7 参照]
9.7 小児等
小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。[9.1.3 参照]
【参考資料】
1) Ebert AD, et al. J Pediatr Adolesc Gynecol 2017; 30: 560-72025年12月改訂
安全性
-
ディナゲストで不正子宮出血の副作用が生じた時の対処法は?
不正子宮出血の副作用は高頻度で認められます(子宮内膜症患者を対象とした国内臨床試験(5試験)において60.6%、子宮内膜症の製造販売後調査において36.4%、子宮腺筋症患者を対象とした国内臨床試験(4試験)において96.8%)。
軽度の場合は、貧血等の検査を行いながら継続投与し、経過観察となりますが、鉄剤の投与や休薬等で回復を待つ場合もあります。
重篤な場合には、輸血を要した症例や子宮全摘術を行った症例もあります。*「Q ディナゲストを長期服用する場合の留意点は?」も参照ください。
電子添文抜粋
8. 重要な基本的注意
8.4 本剤投与後に不正子宮出血があらわれ、重度の貧血に至ることがある。不正子宮出血の程度には個人差があり、投与中に出血が持続する場合や一度に大量の出血が生じる場合もあるので、以下の点に注意すること。[2.4、11.1.1 参照]
- 患者にはあらかじめ十分に説明し、出血量が多く持続日数が長い場合や一度に大量の不正子宮出血が認められた場合には、医師へ相談するよう指導すること。
- 貧血のある患者では、必要に応じて本剤投与前に貧血の治療を行うこと。
- 不正子宮出血が認められた場合には必要に応じて血液検査を実施し、患者の状態を十分に観察すること。異常が認められた場合には鉄剤の投与又は本剤の投与中止、輸血等の適切な処置を行うこと。
- 子宮内膜症患者を対象とした国内臨床試験において、子宮腺筋症又は子宮筋腫を合併する患者での貧血の発現率は、合併しない患者と比較して高い傾向が認められている。
2025年12月改訂
-
ディナゲストは術前の休薬は必要ですか?
血液凝固系には、ほとんど影響しないと考えられますので、術前休薬の必要はありません。
国内の長期投与試験で凝固機能への影響を検討した結果、フィブリノゲン、アンチトロンビンⅢ活性、プロトロンビン時間、APTT(活性化部分トロンボプラスチン延長時間)の検査値は投与期間中に変動しましたが、その平均値はいずれも基準値の範囲内の推移でした1)。
【参考資料】
1) ディナゲスト錠1mg 子宮内膜症申請資料概要 2.7.4.3 臨床検査値の評価2025年12月改訂
-
ディナゲストを長期服用する場合の留意点は?
「血液検査(貧血検査を含む)」「骨塩量検査」等を定期的に行ってください。なお、不正子宮出血が持続的に認められる場合は類似疾患(悪性腫瘍等)との鑑別のために画像診断等を行ってください。
一般にエストロゲン低下作用を有する薬剤では、その作用の程度にもよりますが、投与期間の延長により累積的に骨塩量が減少するおそれがあります。ディナゲストもエストロゲン低下作用を有することから、長期に服用する場合は定期的に骨塩量検査を行ってください。
また、薬剤を長期投与する場合の一般的な肝機能等の血液検査も併せて実施してください。
なお、不正子宮出血が継続的に認められた場合は、類似疾患(悪性腫瘍等)との鑑別のために必要に応じて、画像診断、病理学的検査等を実施し、患者の状態に十分注意してください。
また、貧血が認められた場合には、鉄剤の投与又はディナゲストの投与中止、輸血等の適切な処置を行ってください。電子添文抜粋
8. 重要な基本的注意
8.5 本剤を長期投与する場合には以下の点に注意すること。
- 不正子宮出血が持続的に認められている患者は、類似疾患(悪性腫瘍等)に起因する出血との鑑別に留意し、定期的に画像診断等を行うなど、患者の状態に十分注意すること。また、必要に応じ細胞診等の病理学的検査の実施を考慮すること。
- 本剤の1年を超える投与における有効性及び安全性は確立していないので、1年を超える投与は治療上必要と判断される場合にのみ行い、定期的に臨床検査(血液検査、骨塩量検査等)等を行うなど、患者の状態に十分注意すること。
2025年12月改訂
-
ディナゲストの不正子宮出血は長く飲み続けると減少するのですか?
子宮内膜症および子宮腺筋症の長期投与試験において不正子宮出血の頻度や日数は、投与開始8週時に最も増加し、以降は減少する傾向が見られます。
なお、投与期間に関係なく大量出血をきたす場合もありますのでディナゲスト服用中は注意してください。【不正子宮出血の頻度(通常の月経程度以上の出血が発現した患者の割合)】
子宮内膜症では8週目で33.3%、以後漸減し、24週目で18.3%、52週目で4.3%でした1)。
子宮腺筋症では8週目で20.3%、以後漸減し、24週目で15.4%、52週目で6.8%でした2)。【不正子宮出血の認められた日数(それぞれの投与月(28日間)当たりの日数)】
子宮内膜症では8週目で18.7日、以後漸減し、24週目で11.3日、52週目で6.4日でした1)。
子宮腺筋症では8週目で17.5日、以後漸減し、24週目で11.3日、52週目で5.5日でした2)。【参考資料】
1) インタビューフォーム Ⅴ. 治療に関する項目 5. 臨床成績<子宮内膜症> (4)検証的試験 2)安全性試験 第Ⅲ相長期投与試験
2) インタビューフォーム Ⅴ. 治療に関する項目 5. 臨床成績<子宮腺筋症に伴う疼痛の改善> (4)検証的試験 2)安全性試験
第Ⅲ相長期投与試験2025年12月改訂
-
ディナゲストにアナフィラキシーの報告はありますか?
子宮内膜症患者および子宮腺筋症患者を対象としたディナゲストの国内臨床試験ではアナフィラキシーの報告はありませんでしたが、国内市販後において、アナフィラキシーの報告が集積されています。
アナフィラキシー(呼吸困難、血管浮腫、蕁麻疹、そう痒感等)があらわれた場合には投与を中止し、適切な処置を行ってください。電子添文抜粋
11. 副作用
11.1 重大な副作用
11.1.2 アナフィラキシー(頻度不明)
アナフィラキシー(呼吸困難、血管浮腫、蕁麻疹、そう痒感等)があらわれることがあるので、このような症状があらわれた場合には投与を中止し、適切な処置を行うこと。
2025年12月改訂
薬物動態
-
ディナゲストは食事の影響を受けますか?
食事の影響は少ないと考えられます。
絶食下および非絶食下において、ディナゲスト1mgを単回投与し体内動態を比較したところ、摂食による吸収の遅延(Tmax1.3hr→2.1hr)が認められるものの、AUCにはほとんど影響せず、食事の影響は少ない1)と考えられました。
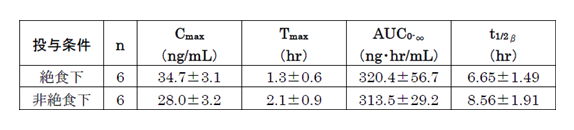
電子添文抜粋
16. 薬物動態
16.2 吸収
16.2.1 食事の影響
健康成人女性に本剤0.5mg、1mg、2mgを単回経口投与注)したとき、摂食による吸収の遅延は認められるものの、吸収率及び消失速度には影響せず、食事の影響は少ないと考えられた。
注)本剤の承認された用法及び用量は「1日2mgを2回に分け経口投与」である。
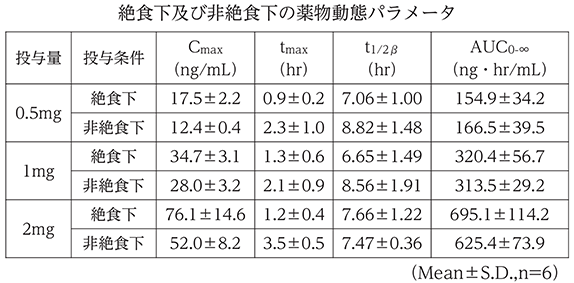
【参考資料】
1) インタビューフォーム Ⅶ. 薬物動態に関する項目 1. 血中濃度の推移 (4)食事・併用薬の影響 1)食事の影響2025年12月改訂
薬効薬理
-
ディナゲストによる不正子宮出血が起きるメカニズムは?
ディナゲストのプロゲステロン作用により形成される子宮内膜の偽脱落膜部位の破綻1)による出血と考えられます。
月経周期2~5日目よりディナゲストを服用すると卵胞の発育が抑制され、エストロゲンの産生が低下するため、子宮内膜が厚くならないまま分泌期を迎えます。分泌期において、ディナゲストはそのプロゲステロン作用により子宮内膜の間質細胞を脱落膜へと変化させますが(偽脱落膜化)、通常の月経周期に比べて子宮内膜が薄く剥がれ易いため予期しない時に出血が起こります。
【参考資料】
1) Irahara M, et al. Reprod Med Biol 2007; 6: 223-82025年12月改訂
製剤
-
ディナゲスト錠の無包装での安定性は?
日本病院薬剤師会で定めた温度、湿度および光の3つの保存条件1)にて無包装状態での安定性試験2)を行っております。
- 温度(40℃、3ヵ月)条件では外観、含量、硬度、溶出性はともに変化なしでした。
- 湿度(30℃、75%RH、3ヵ月)条件では外観、含量、溶出性はともに変化なしでしたが、硬度の低下(規格内)が認められました。
開始時:約7.4kg重→1ヵ月:5.2kg重(規格内)→3ヵ月:約4.5kg重に低下(規格内) - 光(総照度60万lux・hr)条件では外観、含量、硬度、溶出性はともに変化なしでした。
電子添文抜粋
20. 取扱い上の注意
PTPシートからの取り出し後は、遮光して保存すること。
【参考資料】
1) 西岡 豊 他編. 錠剤・カプセル剤の無包装状態での安定性情報. 改訂6版. 医薬ジャーナル社; 2009. p.441-4
2) 持田製薬社内資料(安定性検討結果)2025年12月改訂

