製品Q&Aご使用にあたり
本Q&Aは、医療従事者向けの内容で、医療従事者が患者に対して行う診断、指導、助言等に代替するものではありません。また、掲載している情報は、医療従事者が製品の適正な使用を行うための一般的情報または参考情報であり、全ての症例またはケースに適応するものではありません。従いまして、本Q&Aのご利用によって生じた結果については、責任を負いかねますのでご了承ください。
本Q&Aには、承認外の内容(用法・用量、適応、剤形等)が含まれている場合がありますので、ご注意ください。製品のご使用に当たっては、最新の添付文書をご確認くださいますようお願いいたします。
なお、本Q&Aを許可なく複写、複製、転掲、頒布、改変等を行うことはご遠慮ください。
治療
-
開発の経緯は?
トラムセット®配合錠は、1錠中にオピオイド(非麻薬)「トラマドール塩酸塩」37.5mgと解熱鎮痛剤「アセトアミノフェン」325mgを配合した本邦初の鎮痛剤です。
トラマドール塩酸塩はドイツ、Grünenthal GmbH社が開発したオピオイド(非麻薬)で、μオピオイド受容体に対する作用及びモノアミン再取り込み阻害作用により、鎮痛効果を示すと考えられています1)~4)。
アセトアミノフェンは1940年代から汎用されているアニリン系解熱鎮痛剤で、非ステロイド性消炎鎮痛剤(NSAIDs)とは異なり、末梢でのシクロオキシゲナーゼ阻害作用は弱く、主に中枢神経系で鎮痛作用を示すと考えられています5)。
米国R.W. Johnson Pharmaceutical Research Institute社(現Johnson&Johnson Pharmaceutical Research & Development社)は、作用機序の異なるこの2つの鎮痛剤を併用することにより、多様な疼痛疾患に有効性が期待できることに着目し、配合錠の開発を行いました。以後、数々の臨床試験を経て、トラマドール塩酸塩/アセトアミノフェン配合錠は世界68の国と地域で承認されています(2020年8月現在)。
本邦ではヤンセンファーマ株式会社が臨床試験を実施し、非オピオイド鎮痛剤で治療困難な非がん性慢性疼痛及び抜歯後の疼痛に対して効能・効果をもつ治療剤として、2011年4月、承認を取得しました。299例の使用成績調査、1,304例の特定使用成績調査を実施し、2017年7月21日に再審査申請を行った結果、2018年9月27日に医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律第14条第2項第3号イからハまでのいずれにも該当しないとの再審査結果を得ました。【引用文献】
1) 満島隆, 他:日薬理誌, 68:437, 1973
2) Hennies, H.H., et al. : Arzneim. -Forsch./Drug Res., 38 : 877, 1988
3) Driessen, B., et al. : Br. J. Pharmacol., 105 : 147, 1992
4) Bamigbade, T.A., et al. : Br. J. Anaesth., 79 : 352, 1997
5) Warner, T.D., et al. : Proc. Natl. Acad. Sci. USA., 96:7563, 19992024年1月改訂
薬効薬理
-
作用機序は?
作用機序を以下に示します。
-
トラマドール1)、2)
ラット脳を用いたin vitro試験の結果から、トラマドールは中枢神経系で作用し、トラマドール及び活性代謝物M1のμ-オピオイド受容体への結合、並びにトラマドールによるノルアドレナリン及びセロトニンの再取り込み阻害作用が、鎮痛作用に関与すると考えられる。
-
アセトアミノフェン3)、4)
ラットを用いたin vivo試験の結果から、アセトアミノフェンは主に中枢神経系で作用し、N-メチル-D-アスパラギン酸受容体及びサブスタンスP受容体を介した一酸化窒素経路の阻害作用、脊髄のセロトニン受容体を介した間接的な作用などが、鎮痛作用に関与すると考えられる。
【引用文献】
1) Raffa, R.B., et al.: J. Pharmacol. Exp. Ther., 260 : 275, 1992
2) Raffa, R.B. : Am. J. Med., 101(suppl 1A) : 40S, 1996
3) Björkman, R., et al. : Pain, 57 : 259, 1994
4) Pelissier, T., et al. : J. Pharmacol. Exp. Ther., 278 : 8, 19962017年3月作成
-
用法・用量
-
トラマドールやアセトアミノフェンと併用を避ける理由は?
トラムセット®はトラマドールとアセトアミノフェンの配合剤であることから、トラマドールまたはアセトアミノフェンを含有する他剤と併用した時、過量投与となるおそれがあるため、併用は避けてください。特にアセトアミノフェンを含有する一般用医薬品は多数存在することから、一般用医薬品も含めて併用を避けるよう注意してください。
添付文書抜粋
1. 警告
1.2 本剤とトラマドール又はアセトアミノフェンを含む他の薬剤(一般用医薬品を含む)との併用により、過量投与に至るおそれがあることから、これらの薬剤との併用を避けること。[13.1、13.2参照]
2024年1月改訂
-
減量・中止の方法は?
減量及び中止方法は設定していませんが、退薬症候が生じる可能性があるため、漸減して中止するのが好ましいと考えられます。一般的には、2~3日ごとに1日投与量の1/4~1/2を減量すると退薬症候は生じないと言われています1)。
添付文書抜粋
7. 用法及び用量に関連する注意
〈非がん性慢性疼痛〉
7.2 投与の中止
本剤の投与を必要としなくなった場合は、退薬症候の発現を防ぐために徐々に減量すること。【引用文献】
1) 宮野早苗 他:ペインクリニシャンのためのオピオイドの基礎と臨床,66-86,20042019年7月改訂
-
いつもの時間に飲み忘れてしまったが、どうしたらよいか?
飲み忘れた場合は、忘れた分を気がついた時にできるだけ早く飲ませてください。ただし、次の服用は4時間以上空けて飲ませてください。2回分を一度に飲まないようにさせてください。
2017年9月改訂
副作用
-
副作用には主にどのようなものがあるのか?
<承認時>1)
慢性疼痛及び抜歯後疼痛を有する患者を対象に実施した国内臨床試験における安全性評価対象症例599例中486例(81.1%)に副作用(臨床検査値異常を含む)が認められました。主なものは、悪心248例(41.4%)、嘔吐157例(26.2%)、傾眠155例(25.9%)、便秘127例(21.2%)、浮動性めまい113例(18.9%)でした。
<再審査終了時>1)
慢性疼痛を対象とした特定使用成績調査における副作用(臨床検査値異常を含む)は1262例中289例(22.9%)に認められました。主な副作用は、悪心91例(7.2%)、便秘72例(5.7 %)、浮動性めまい32例(2.5 %)、傾眠32例(2.5%)、嘔吐21例(1.7%)でした。
抜歯後疼痛を対象とした使用成績調査における副作用(臨床検査値異常を含む)は297例中112例(37.7%)に認められました。主な副作用は、悪心69例(23.2%)、嘔吐28例(9.4%)、浮動性めまい21例(7.1%)、傾眠16例(5.4%)、倦怠感4例(1.4%)、便秘3例(1.0%)でした。【引用文献】
1)トラムセット®配合錠インタビューフォーム Ⅷ. 安全性(使用上の注意等)に関する項目 8. 副作用2024年1月改訂
過量投与
-
過量に投与した際の対処方法は?
対処方法は、添付文書に記載の内容の処置をご検討ください。
添付文書抜粋
13. 過量投与
13.1 症状
トラマドールの過量投与による重篤な症状は、呼吸抑制、嗜眠、昏睡、痙攣発作、心停止である。
アセトアミノフェンの大量投与により、肝毒性のおそれがある。また、アセトアミノフェンの過量投与時に肝臓・腎臓・心筋の壊死が起こったとの報告がある。過量投与による主な症状は、胃腸過敏症、食欲不振、悪心、嘔吐、倦怠感、蒼白、発汗等である。[1.2参照]13.2 処置
緊急処置として、気道を確保し、症状に応じた呼吸管理と循環の管理を行うこと。
トラマドールの過量投与による呼吸抑制等の症状が疑われる場合には、ナロキソンが有効な場合があるが、痙攣発作を誘発するおそれがある。また、トラマドールは透析によりほとんど除去されない。
アセトアミノフェンの過量投与による症状が疑われる場合には、アセチルシステインの投与を考慮すること。[1.2参照]参考:『Q 透析で除去されるか?』
2024年1月改訂
相互作用
-
他剤との相互作用は?
トラマドールは、主にCYP2D6及びCYP3A4によって代謝されます。添付文書において併用禁忌、併用注意の薬剤が設定されていますので、最新の添付文書(10. 相互作用 10.1 併用禁忌 10.2 併用注意)にてご確認ください。
2019年7月改訂
特殊患者
-
肝障害患者における体内動態は?
肝障害患者において、トラムセット®の体内動態を検討した報告はありません。
トラマドール及びアセトアミノフェンの肝障害患者における体内動態を下記に示します。【参考:外国人データ】
-
トラマドール
肝硬変患者12例にトラマドール塩酸塩カプセル50mgを経口投与した時、健康成人と比較して血清中トラマドールのCmax及びAUC∞は顕著に増加し、t1/2は約2.6倍に延長した1)。
-
アセトアミノフェン
肝機能障害患者(軽度~中等度:9例、高度:5例)にアセトアミノフェン1000mgを経口投与した時、健康成人と比較して血漿中アセトアミノフェンのAUC6hは約1.7倍増加し、t1/2は約2時間延長した2)。
添付文書抜粋
1. 警告
1.1 本剤により重篤な肝障害が発現するおそれがあることに注意し、アセトアミノフェンの1日総量が1500mg(本剤4錠)を超す高用量で長期投与する場合には、定期的に肝機能等を確認するなど、慎重に投与すること。[8.6参照]
2. 禁忌(次の患者には投与しないこと)
2.6 重篤な肝障害のある患者[重篤な転帰をとるおそれがある。][9.3.1参照]
8. 重要な基本的注意
8.6 重篤な肝障害が発現するおそれがあるので注意すること。アセトアミノフェンの1日総量が1500mg(本剤4錠)を超す高用量で長期投与する場合には定期的に肝機能検査を行い、患者の状態を十分に観察すること。高用量でなくとも長期投与する場合にあっては定期的に肝機能検査を行うことが望ましい。また、高用量で投与する場合などは特に患者の状態を十分に観察すること。[1.1、11.1.9参照]
9. 特定の背景を有する患者に関する注意
9.3 肝機能障害患者
9.3.1 重篤な肝障害のある患者
投与しないこと。重篤な転帰をとるおそれがある。[2.6参照]9.3.2 肝障害のある患者あるいはその既往歴のある患者(重篤な肝障害のある患者を除く)
肝機能が悪化するおそれがある。また、高い血中濃度が持続し、作用及び副作用が増強するおそれがある。[16.6.1参照]16.6 特定の背景を有する患者
16.6.1 肝機能障害
(1)トラマドール
肝硬変患者12例にトラマドール塩酸塩カプセル50mgを経口投与したとき、健康成人と比較して血清中トラマドールのCmax及びAUC∞は顕著に増加し、t1/2は約2.6倍に延長した(外国人データ)。[9.3.2参照](2)アセトアミノフェン
肝機能障害患者(軽度~中等度:9例、高度:5例)にアセトアミノフェン1000mgを経口投与したとき、健康成人と比較して血漿中アセトアミノフェンのAUC6hは約1.7倍増加し、t1/2は約2時間延長した(外国人データ)。[9.3.2参照]【引用文献】
1)トラマドール塩酸塩OD錠添付文書
2)Zapater, P., et al. : Ailment. Pharmacol. Ther., 20 : 29, 20042024年1月改訂
-
-
肝障害患者への投与量は?
重篤な肝障害のある患者は、重篤な転帰をとるおそれがあるため、禁忌です。また、肝障害あるいはその既往歴のある患者は、肝機能が悪化するおそれがあり、高い血中濃度が持続し、作用及び副作用が増強するおそれがあるため、慎重に投与してください。
なお、肝障害の程度による用量調節についての目安は設定しておりません。添付文書抜粋
1. 警告
1.1 本剤により重篤な肝障害が発現するおそれがあることに注意し、アセトアミノフェンの1日総量が1500mg(本剤4錠)を超す高用量で長期投与する場合には、定期的に肝機能等を確認するなど、慎重に投与すること。[8.6参照]
2. 禁忌(次の患者には投与しないこと)
2.6 重篤な肝障害のある患者[重篤な転帰をとるおそれがある。][9.3.1参照]
8. 重要な基本的注意
8.6 重篤な肝障害が発現するおそれがあるので注意すること。アセトアミノフェンの1日総量が1500mg(本剤4錠)を超す高用量で長期投与する場合には定期的に肝機能検査を行い、患者の状態を十分に観察すること。高用量でなくとも長期投与する場合にあっては定期的に肝機能検査を行うことが望ましい。また、高用量で投与する場合などは特に患者の状態を十分に観察すること。[1.1、11.1.9参照]
9. 特定の背景を有する患者に関する注意
9.3 肝機能障害患者
9.3.1 重篤な肝障害のある患者
投与しないこと。重篤な転帰をとるおそれがある。[2.6参照]9.3.2 肝障害のある患者あるいはその既往歴のある患者(重篤な肝障害のある患者を除く)
肝機能が悪化するおそれがある。また、高い血中濃度が持続し、作用及び副作用が増強するおそれがある。[16.6.1参照]16.6 特定の背景を有する患者
16.6.1 肝機能障害
(1)トラマドール
肝硬変患者12例にトラマドール塩酸塩カプセル50mgを経口投与したとき、健康成人と比較して血清中トラマドールのCmax及びAUC∞は顕著に増加し、t1/2は約2.6倍に延長した(外国人データ)。[9.3.2参照](2)アセトアミノフェン
肝機能障害患者(軽度~中等度:9例、高度:5例)にアセトアミノフェン1000mgを経口投与したとき、健康成人と比較して血漿中アセトアミノフェンのAUC6hは約1.7倍増加し、t1/2は約2時間延長した(外国人データ)。[9.3.2参照]2024年1月改訂
-
腎障害患者における体内動態は?
腎障害患者において、トラムセット®の体内動態を検討した報告はありません。
トラマドール及びアセトアミノフェンの腎障害患者における体内動態を下記に示します。【参考:外国人データ】
-
トラマドール
腎機能障害患者(クレアチニンクリアランス:80mL/min以下)21例にトラマドール塩酸塩100mgを静脈内投与した時、血清中トラマドールのt1/2及びAUC∞は健康成人のそれぞれ最大で1.5倍及び2倍であった1)。
-
アセトアミノフェン
腎機能障害患者(クレアチニンクリアランス:30mL/min以下)13例にアセトアミノフェン1000mgを経口投与した時、投与8~24時間後の血漿中アセトアミノフェンのt1/2は健康成人(4.9時間)と比較して11.7時間に延長し、AUC8-24hも約1.9倍増加した2)。
添付文書抜粋
9. 特定の背景を有する患者に関する注意
9.2 腎機能障害患者
9.2.1 腎障害のある患者あるいはその既往歴のある患者
投与量の減量、投与間隔の延長を考慮すること。症状が悪化又は再発を促すおそれがある。また、高い血中濃度が持続し、作用及び副作用が増強するおそれがある。[16.6.2参照]16.6 特定の背景を有する患者
16.6.2 腎機能障害
(1)トラマドール
腎機能障害患者(クレアチニンクリアランス:80mL/min以下)21例にトラマドール塩酸塩100mgを静脈内投与したとき、血清中トラマドールのt1/2及びAUC∞は健康成人のそれぞれ最大で1.5倍及び2倍であった(外国人データ)。[9.2.1参照](2)アセトアミノフェン
腎機能障害患者(クレアチニンクリアランス:30mL/min以下)13例にアセトアミノフェン1000mgを経口投与したとき、投与8~24時間後の血漿中アセトアミノフェンのt1/2は健康成人(4.9時間)と比較して11.7時間に延長し、AUC8-24hも約1.9倍増加した(外国人データ)。[9.2.1参照]【引用文献】
1)トラマドール塩酸塩OD錠添付文書
2)Prescott, L.F., et al. : Eur. J. Clin. Pharmacol., 36 : 291, 19892024年1月改訂
-
-
腎障害患者、透析患者への投与量は?
腎障害あるいはその既往歴のある患者は、投与量の減量、投与間隔の延長を考慮してください。
症状の悪化又は再発を促したり、高い血中濃度が持続し、作用及び副作用が増強するおそれがあります。
なお、腎障害の程度による用量調節についての目安は設定しておりません。添付文書抜粋
9. 特定の背景を有する患者に関する注意
9.2 腎機能障害患者
9.2.1 腎障害のある患者あるいはその既往歴のある患者
投与量の減量、投与間隔の延長を考慮すること。症状が悪化又は再発を促すおそれがある。また、高い血中濃度が持続し、作用及び副作用が増強するおそれがある。[16.6.2参照]16.6 特定の背景を有する患者
16.6.2 腎機能障害
(1)トラマドール
腎機能障害患者(クレアチニンクリアランス:80mL/min以下)21例にトラマドール塩酸塩100mgを静脈内投与したとき、血清中トラマドールのt1/2及びAUC∞は健康成人のそれぞれ最大で1.5倍及び2倍であった(外国人データ)。[9.2.1参照](2)アセトアミノフェン
腎機能障害患者(クレアチニンクリアランス:30mL/min以下)13例にアセトアミノフェン1000mgを経口投与したとき、投与8~24時間後の血漿中アセトアミノフェンのt1/2は健康成人(4.9時間)と比較して11.7時間に延長し、AUC8-24hも約1.9倍増加した(外国人データ)。[9.2.1参照]2024年1月改訂
-
透析で除去されるか?
透析患者において、トラムセット®の除去率を検討した報告はありません。
トラマドール及びアセトアミノフェンの透析患者における除去率を下記に示します。【参考:透析などによる除去率(外国人データ)】
-
トラマドール1)
トラマドール単剤投与において、4時間の血液透析で除去されるトラマドール及び活性代謝物M1は、投与量の7%未満であった。
-
アセトアミノフェン2)
透析除去率:10%
添付文書抜粋
9. 特定の背景を有する患者に関する注意
9.2 腎機能障害患者
9.2.1 腎障害のある患者あるいはその既往歴のある患者
投与量の減量、投与間隔の延長を考慮すること。症状が悪化又は再発を促すおそれがある。また、高い血中濃度が持続し、作用及び副作用が増強するおそれがある。[16.6.2参照]16.6 特定の背景を有する患者
16.6.2 腎機能障害
(1)トラマドール
腎機能障害患者(クレアチニンクリアランス:80mL/min以下)21例にトラマドール塩酸塩100mgを静脈内投与したとき、血清中トラマドールのt1/2及びAUC∞は健康成人のそれぞれ最大で1.5倍及び2倍であった(外国人データ)。[9.2.1参照](2)アセトアミノフェン
腎機能障害患者(クレアチニンクリアランス:30mL/min以下)13例にアセトアミノフェン1000mgを経口投与したとき、投与8~24時間後の血漿中アセトアミノフェンのt1/2は健康成人(4.9時間)と比較して11.7時間に延長し、AUC8-24hも約1.9倍増加した(外国人データ)。[9.2.1参照]【引用文献】
1)Raffa, R.B., et al. : Rev. Contemp. Pharmacother., 6 : 485, 1995
2)平田純生, 他:透析会誌, 37:1893, 20042024年1月改訂
-
-
高齢者への投与方法は?
高齢者において、トラムセット®の体内動態を検討した報告はありません。一般的に、高齢者では肝臓、腎臓等の機能が低下していることが多く、本剤の代謝や排泄が遅延し、副作用が増強される可能性があることから、副作用の発現に注意し、十分に観察しながら慎重に投与してください。
添付文書抜粋
9. 特定の背景を有する患者に関する注意
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。生理機能が低下していることが多く、代謝・排泄が遅延し副作用があらわれやすい。2019年7月改訂
-
妊婦に使用した報告は?
トラマドール及びアセトアミノフェンは胎盤を通過し、胎児への移行が報告1)~3)されていることから、妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与してください。
添付文書抜粋
9. 特定の背景を有する患者に関する注意
9.5 妊婦
9.5.1 妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
トラマドールは胎盤関門を通過し、新生児に痙攣発作、身体的依存及び退薬症候、並びに胎児死亡及び死産が報告されている。また、動物実験で、トラマドールは器官形成、骨化及び出生児の生存に影響を及ぼすことが報告されている。9.5.2 妊娠後期の女性へのアセトアミノフェンの投与により胎児に動脈管収縮を起こすことがある。
9.5.3 アセトアミノフェンは妊娠後期のラットで胎児に軽度の動脈管収縮を起こすことが報告されている。
【引用文献】
1)Claahsen-van der Grinten, H.L., et al. : Eur. J. Clin. Pharmacol., 61 : 523, 2005
2)Zhao, L.M., et al. : Yao Xue Xue Bao (Acta. Pharmaceutica. Sinica.),39 : 458, 2004
3)Naga Rani, M.A., et al. : J. Indian Med. Assoc., 87 : 182, 19892024年1月改訂
-
授乳婦に使用した報告は?
授乳婦において、トラマドールの投与により乳汁への移行が報告されていることから、授乳は避けさせてください。
【参考】
-
トラマドール
静脈内投与(国内未承認)の場合、0.1%が乳汁中に移行することが知られている1)。
添付文書抜粋
9. 特定の背景を有する患者に関する注意
9.6 授乳婦
授乳を避けさせること。トラマドールは、乳汁中へ移行することが報告されている。【引用文献】
1)トラマドール塩酸塩OD錠添付文書2019年7月改訂
-
薬物動態
-
食事の影響を受けるか?
外国人健康成人にトラムセット®3錠注)(トラマドール塩酸塩として112.5mg、アセトアミノフェンとして975mg)を高脂肪食後及び空腹時にそれぞれ単回経口投与した時、(±)-トラマドール、(±)-M1(活性代謝物O-脱メチルトラマドール)及びアセトアミノフェンの薬物動態に食事による顕著な影響は認められませんでした。
なお、一般に悪心、嘔吐等の消化器症状は、食後に投与することで軽減される可能性がありますので、添付文書において「空腹時の投与は避けることが望ましい。」と記載しています。【参考】
-
食事による影響(外国人データ)1)
外国人健康成人23例に本剤3錠注)(トラマドール塩酸塩/アセトアミノフェンとして112.5mg/ 975mg)を空腹時及び高脂肪食後にそれぞれ単回経口投与し、血漿中(+)及び(−)-トラマドール、(+)及び(−)-M1並びにアセトアミノフェンの薬物動態に対する食事の影響を検討した。その結果、食後投与の血漿中(+)及び(−)-トラマドール、(+)- M1、アセトアミノフェンのtmaxは空腹時投与よりいずれも有意に延長した(分散分析、p≤0.05)。
また、血漿中アセトアミノフェンのCmaxは、空腹時投与に比べて16%低値を示した。しかし、血漿中(+)及び(−)-トラマドール、(+)及び(−)-M1並びにアセトアミノフェンのAUCの変化は±6%以内であり、幾何平均値の比の90%信頼区間は、食事の影響がないことを示す範囲(80~125%)内であった。
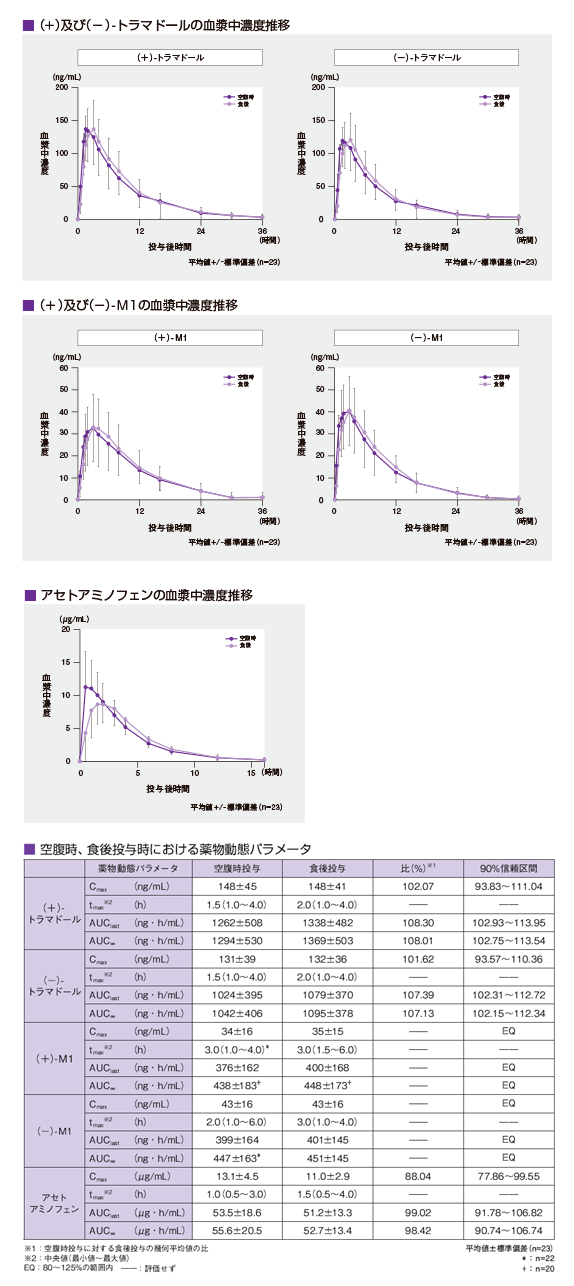
注: 本剤の非がん性慢性疼痛、抜歯後の疼痛に対して承認されている用法及び用量は、「非がん性慢性疼痛:通常、成人には、1回1錠、1日4回経口投与する。投与間隔は4時間以上空けること。なお、症状に応じて適宜増減するが、1回2錠、1日8錠を超えて投与しないこと。また、空腹時の投与は避けることが望ましい。」「抜歯後の疼痛:通常、成人には、1回2錠を経口投与する。なお、追加投与する場合には、投与間隔を4時間以上空け、1回2錠、1日8錠を超えて投与しないこと。また、空腹時の投与は避けることが望ましい。」である。 【引用文献】
1)トラムセット®配合錠海外第Ⅰ相臨床試験(TRAMAP-PHI-003)(社内資料)2024年1月改訂
-
-
血中濃度の推移は?
【単回投与】1)、2)
健康成人男性にトラムセット®1~3錠注)(トラマドール塩酸塩として37.5、75及び112.5mg、アセトアミノフェンとして325、650及び 975mg)を単回経口投与した時、投与量にかかわらず、トラマドール及びアセトアミノフェンは速やかに吸収され、(±)-トラマドール及びアセトアミノフェンの血漿中濃度はそれぞれ投与後約1~2時間及び約1時間にCmaxに達した後、それぞれ約5~5.5時間及び約3時間のt1/2で低下した。両薬物の薬物動態は用量比例性を示した。また、(±)-トラマドールは速やかに活性代謝物O-脱メチルトラマドール【(±)-M1】に代謝され、(±)-M1 の血漿中濃度は投与後約2時間にCmaxに達した後、約6.5時間のt1/2で低下した。血漿中(±)-トラマドール及び(±)-M1の各鏡像異性体【(+)-体及び(−)-体】の血漿中濃度推移及び薬物動態パラメータは類似していた。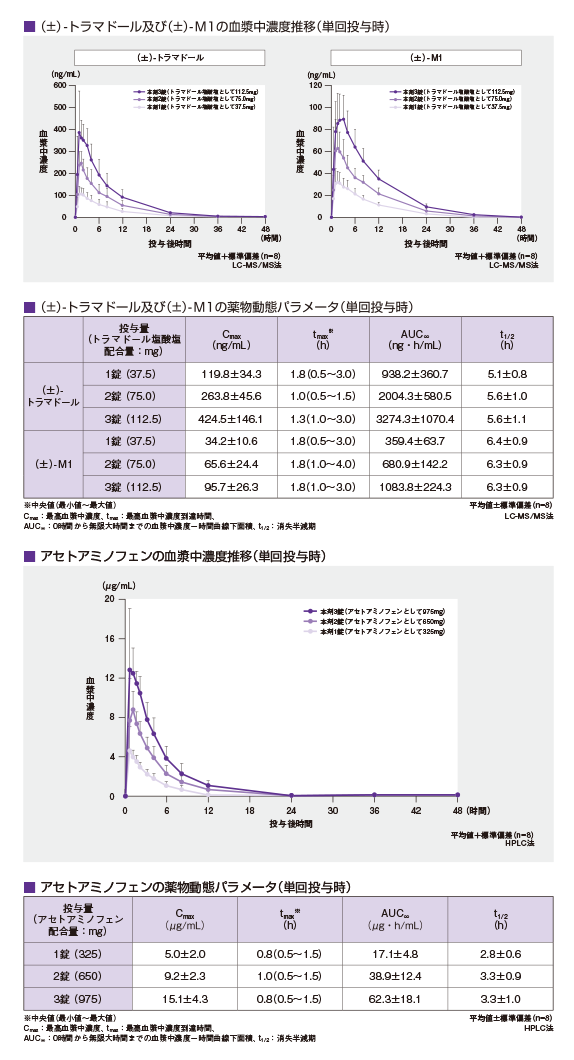
注: 本剤の非がん性慢性疼痛、抜歯後の疼痛に対して承認されている用法及び用量は、「非がん性慢性疼痛:通常、成人には、1回1錠、1日4回経口投与する。投与間隔は4時間以上空けること。なお、症状に応じて適宜増減するが、1回2錠、1日8錠を超えて投与しないこと。また、空腹時の投与は避けることが望ましい。」「抜歯後の疼痛:通常、成人には、1回2錠を経口投与する。なお、追加投与する場合には、投与間隔を4時間以上空け、1回2錠、1日8錠を超えて投与しないこと。また、空腹時の投与は避けることが望ましい。」である。 【反復投与】1)、2)
健康成人男性にトラムセット®1回1又は2錠(トラマドール塩酸塩として37.5又は75mg、アセトアミノフェンとして325又は650mg)を1日4回(6時間ごと)反復経口投与(本剤1錠:5日間、本剤2錠:3日間)した時、血漿中(±)-トラマドール及び(±)-M1濃度は反復経口投与開始後48時間までに、また血漿中アセトアミノフェン濃度は反復経口投与開始後24時間までに定常状態に達しており、蓄積性は認められなかった。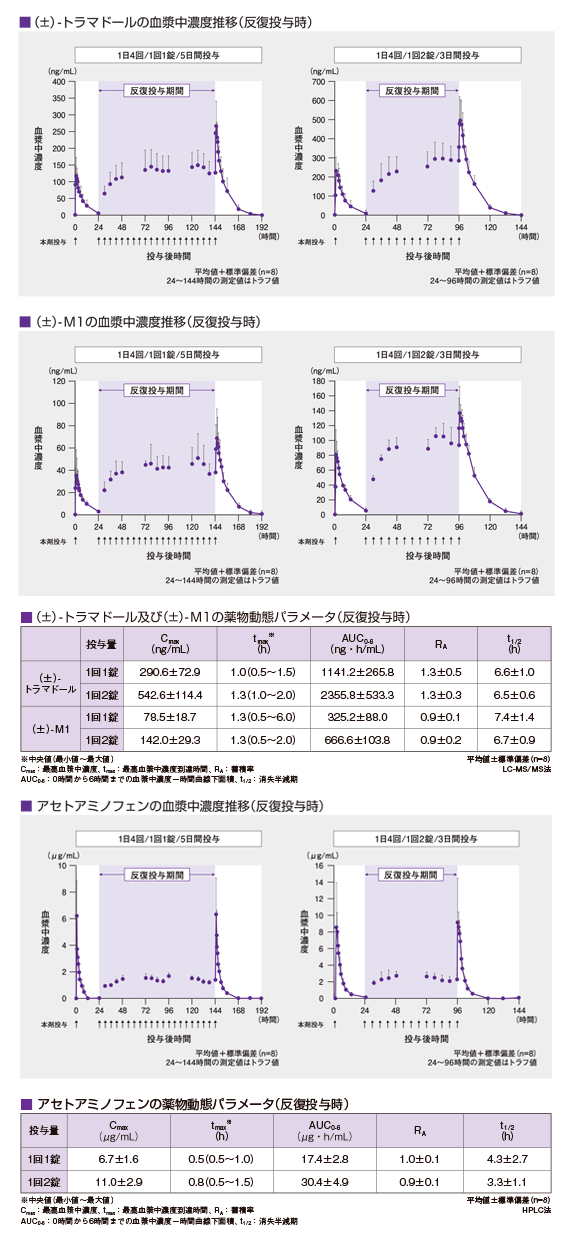
【引用文献】
1)トラムセット®配合錠国内第Ⅰ相臨床試験(JNS013-JPN-01)(社内資料)
2)内田英二, 他:臨床医薬, 28:401, 20122024年1月改訂
製剤
-
製剤の安定性は?
トラムセット®の長期保存試験、中間的試験、加速試験、光安定性試験の結果を以下に示します。
なお、本剤の貯法は「室温保存」です。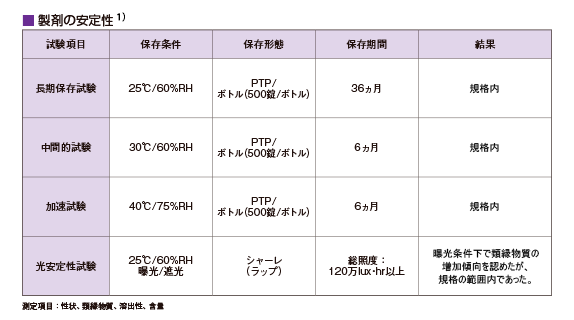
【引用文献】
1)トラムセット®配合錠インタビューフォーム Ⅳ. 製剤に関する項目 6. 製剤の各種条件下における安定性2024年1月改訂

