- 医療関係者向けホーム
- フィルグラスチムBS注「モチダ」
- Clinical Study:乳癌患者対象試験(国内第Ⅲ相試験) 安全性
 Clinical Study乳癌患者対象試験(国内第Ⅲ相試験)
Clinical Study乳癌患者対象試験(国内第Ⅲ相試験)
安全性
副作用
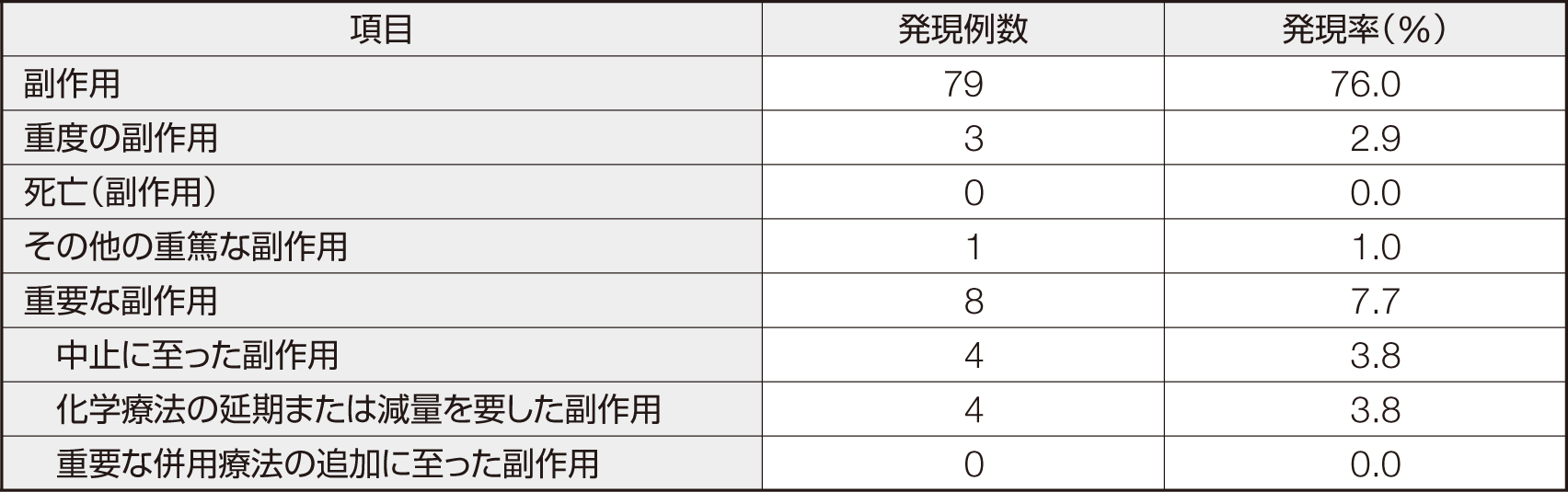
本剤が投与された104例中79例(76.0%)に副作用が認められた。主な副作用は、腰痛・背部痛63例(60.6%)、骨痛10例(9.6%)、関節痛6例(5.8%)、頭痛5例(4.8%)等であった。主な臨床検査値異常変動はALT(GPT)上昇9例(8.7%)、AST(GOT)上昇6例(5.8%)等であった。
重度の副作用は3例(2.9%)に認められ、その内容はALT(GPT)増加、肝障害、骨痛・背部痛であった。死亡は認められなかった。その他の重篤な副作用として1例(1.0%)に陰部ヘルペスが認められた。
中止に至った副作用は4例(3.8%)で、ALT(GPT)増加、肝障害、骨痛・背部痛が認められた。化学療法の延期または減量を要した副作用は4例(3.8%)に認められ、その内容としてALT(GPT)増加、AST(GOT)増加が認められた。重要な併用療法の追加に至った副作用は認められなかった。