製品Q&Aご使用にあたり
本Q&Aは、医療従事者向けの内容で、医療従事者が患者に対して行う診断、指導、助言等に代替するものではありません。また、掲載している情報は、医療従事者が製品の適正な使用を行うための一般的情報または参考情報であり、全ての症例またはケースに適応するものではありません。従いまして、本Q&Aのご利用によって生じた結果については、責任を負いかねますのでご了承ください。
本Q&Aには、承認外の内容(用法・用量、適応、剤形等)が含まれている場合がありますので、ご注意ください。製品のご使用に当たっては、最新の電子添文をご確認くださいますようお願いいたします。
なお、本Q&Aを許可なく複写、複製、転掲、頒布、改変等を行うことはご遠慮ください。
用法・用量
-
グーフィス®は、食前投与ですが、その理由は?
効率の良い効果発現のために食前投与に設定しています。
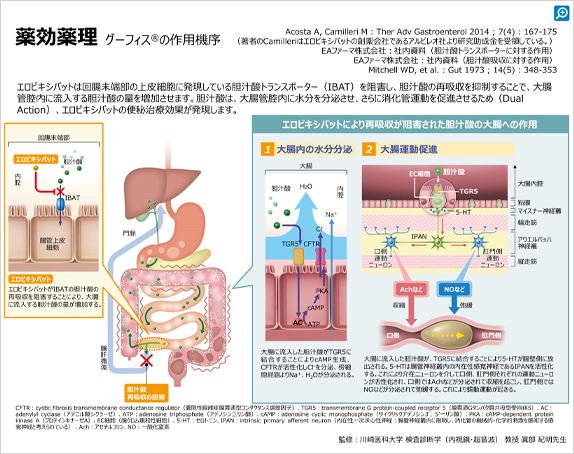
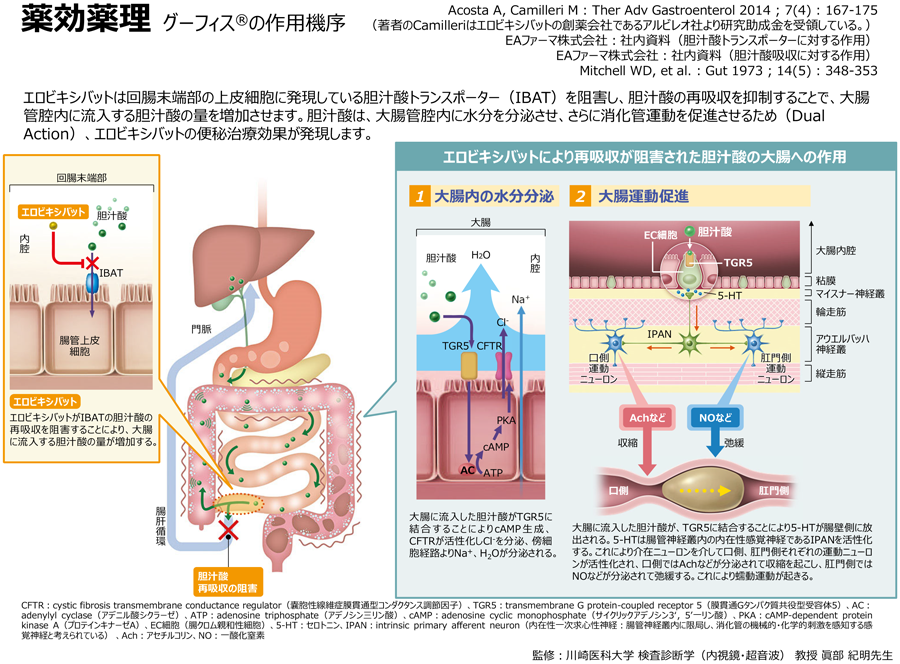
グーフィス®は、血中に移行して効果を発現する薬剤ではなく、回腸末端部で胆汁酸の再吸収に関わるトランスポーター(IBAT:ileal bile acid transporter)を直接阻害し1)、胆汁酸の再吸収を抑制することにより2)、大腸内に流入する胆汁酸の量を増加させる作用を持つ薬剤です。
従って、食事の刺激により胆汁酸が十二指腸に放出される前のタイミングでグーフィス®を投与し、回腸末端部で胆汁酸の再吸収を抑制することが望ましいと考えられます。
国内臨床試験では、いずれも朝食前投与で実施しておりますが、胆汁酸は昼食、夕食後にも分泌されるので、本剤は昼食、夕食前の投与でも朝食前投与と同様に十分な効果を示すと判断されること、朝食を摂取する習慣のない患者様も多数存在すると推定されることから、用法・用量は「食前投与」で承認されています。【参考資料】
1) EAファーマ株式会社:社内資料(胆汁酸トランスポーターに対する作用)(2018年1月19日承認、申請資料概要2.6.2.2)
2) EAファーマ株式会社:社内資料(胆汁酸吸収に対する作用)(2018年1月19日承認、申請資料概要2.6.2.2)2025年11月改訂
-
グーフィス®は、食直前・食後・食間・就寝前、また、頓用で服用してもよいでしょうか?
食直前・食後・食間・就寝前、また、頓用での服用は、承認された用法ではなく、体内動態や安全性・有効性の検討を行っていないため、適正使用の観点から弊社としては推奨していません。
本剤の承認された用法及び用量は、「1日1回、食前に経口投与」です。電子添文抜粋
6. 用法及び用量
通常、成人にはエロビキシバットとして10mgを1日1回食前に経口投与する。なお、症状により適宜増減するが、最高用量は1日15mgとする。
2025年11月改訂
-
グーフィス®は、朝食前・昼食前・夕食前投与で、排便効果に違いがありますか?
朝食前・昼食前・夕食前投与による臨床効果の比較データはありません。国内第Ⅱ相試験、国内第Ⅲ相試験、国内長期投与試験のいずれも、朝食前30分投与で実施していたため、昼食前・夕食前投与との比較データはありません。国内臨床試験では、グーフィス®の投与タイミングは朝食前でしたが、胆汁酸は昼食、夕食後にも分泌されることからグーフィス®は昼食又は夕食前の投与でも朝食前投与と同様の効果を示すと考えられ、投与タイミングは朝食前に限定せず食前で承認されました。
参考までに以下の報告があります。
グーフィス®錠5mg夕食前投与による日本人慢性便秘患者の後ろ向き観察研究1)
対象:エロビキシバット内服前に、RomeⅣ基準により機能性便秘と診断された20歳以上の男女で、週の排便回数が 3回未満であり、調査期間中に夕食前にエロビキシバットを投与されている者(41名)を対象とした。なお、器質性便秘が疑われる者、エロビキシバット服用前2週間以内に酸化マグネシウム、刺激性下剤、上皮機能変容薬、消化管運動促進薬、漢方薬など便秘症治療薬や排便に関与する経口薬を服用している者、精神疾患で向精神薬、抗うつ薬、抗不安薬の服薬歴のある者は除外した。結果:グラフ参照
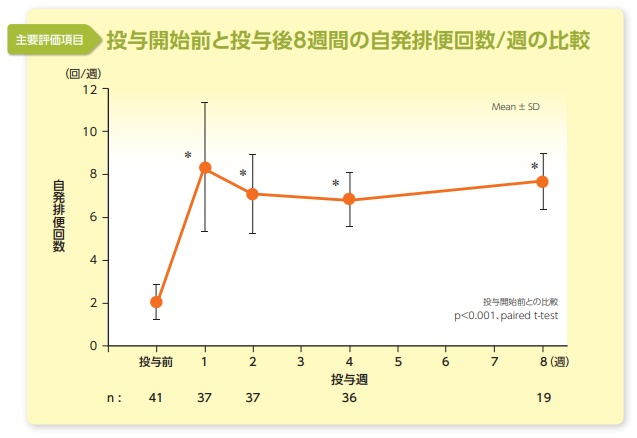
安全性:投与期間中に観察された有害事象はなかった。尚、服薬を中止した3例は水様便と腹痛(重度ではない)によるものであった。
【参考資料】
1) Odaka T, et al. Curr Ther Res Clin Exp 2020; 93: 100616 (当研究はEAファーマ株式会社の支援にて行われた。)2025年11月改訂
-
グーフィス®を食前に飲み忘れた場合の服用は、どうしたらいいですか?
食前に飲み忘れた場合は、次の食事の前に服用してください。絶対に2回分を一度に飲まないでください。
※夕食前服用の飲み忘れの場合
指導箋どおり、飲み忘れ分を次の食事の前(翌日の朝食前)に服用し、その日の夜は休薬する。2025年11月改訂
併用
-
グーフィス®を他の便秘治療薬と併用したときの有効性・安全性は?
グーフィス®の国内臨床試験は単剤で行っており、他の便秘治療薬と併用したときの有効性・安全性については検討したデータがありません。
一方で、市販後の特定使用成績調査3,638例において、そのうちの一部の患者様で塩類下剤や刺激性下剤、腸管分泌促進剤などと併用されている実態はあります。調査全体の副作用は6.35%でした1)。
医療現場では、医師の判断(裁量権)によって、作用機序の異なる便秘治療薬と併用されることもあると思われます。
ただし、保険審査に関しては、地域の審査機関の判断になります。参考
国内第Ⅱ相試験、国内第Ⅲ相試験、国内長期投与試験において、併用が可能とされていた下剤は、救済薬として使用するビサコジル坐剤に限られていました。【参考資料】
1) Nakajima A, et al. SAGE Open Med 2025; 13: 205031212513216592025年11月改訂
臨床効果
-
グーフィス®の効果発現時間(初回自発排便の発現時間)は?
国内第Ⅲ相試験(10mg投与)では、初回の自発排便の発現時間の中央値は、
5.2時間(95%CI:3.4-7.0)でした1)。(n=69)
25Percentile:2.4時間、 75Percentile:10.0時間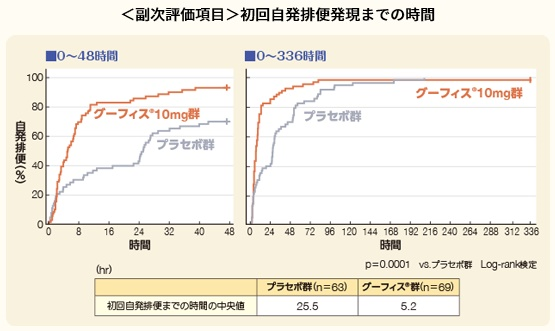
参考
パーセンタイル:percentile(百分位数)
計測値の分布(ばらつき)を小さい数字から大きい数字に並べ変え、パーセント表示することによって、どこに位置するのかを測定する単位。50パーセンタイルが中央値。つまり、全体を100として小さい方から数えて何番目になるのかを示す数値で、「75パーセンタイル」は、小さい方から数えて75番目ということになる。【参考資料】
1) グーフィス®錠5mg CTD 2.7.6.9 国内第Ⅲ相試験(AJG533/CT1)2025年11月改訂
-
グーフィス®による治療を開始してから、どれくらいの時期に臨床効果を判定するのがよいですか?
国内第Ⅱ相試験・国内第Ⅲ相試験では投与7日後に評価、国内長期投与試験では、10mgでの投与開始から7日経過した後に、5mg、10mg、15mgの間で適宜増減を認めているため1)、2)、薬効評価は7日後が目安になると思われます。
【参考資料】
1) グーフィス®錠5mg インタビューフォーム Ⅴ. 治療に関する項目 5. 臨床成績 (3)用量反応探索試験
2) グーフィス®錠5mg インタビューフォーム Ⅴ. 治療に関する項目 5. 臨床成績 (4)検証的試験2025年11月作成
-
グーフィス®の臨床効果は食事の内容(脂肪量)により影響を受けますか?
食事の内容と排便効果を検討した報告はありません。国内臨床試験では、日常の食生活のもとで、有効性と安全性を検討しています。
2025年11月作成
-
グーフィス®の薬剤性便秘、症候性便秘に対する効果は?
国内臨床試験では、薬剤性便秘(オピオイド系薬剤を含む)及び症候性便秘を含む患者は対象から除外していたため、電子添文には、「薬剤性及び症候性の慢性便秘症患者を対象に本剤の有効性及び安全性を評価する臨床試験は実施していない。」と記載しています。
大腸運動能低下の原因は異なるものの、薬剤性便秘及び症候性便秘の病態は機能性便秘と違いはないことから、グーフィス®の大腸運動促進作用により効果は期待できると考えられますが、検討したデータはありません1)。【参考資料】
1) グーフィス®錠5mg 審査報告書 7. 臨床的有効性及び臨床的安全性に関する資料並びに機構における審査の概略
7.R 機構における審査の概略 7.R.4 効能又は効果について2025年11月作成
薬物動態
-
グーフィス®は食事の影響を受けますか?
本剤は回腸末端部の胆汁酸トランスポーター(IBAT)を管腔側から直接阻害し1)、胆汁酸の再吸収を抑制することにより2)、大腸内に流入する胆汁酸の量を増加させ排便効果を発現する薬剤であり、体内に吸収されて作用する薬剤ではありません。そのため本剤は、食事の刺激により胆汁酸が十二指腸に放出される前のタイミングで投与することが望ましく、「食前投与」に設定されています。
*作用機序からは、血中濃度は薬効には影響しないと考えられますが、参考として薬物動態のデータを記載しています。
参考
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
日本人慢性便秘患者を対象に、本剤5mg、10mg、15mgを朝食前に単回経口投与した時の薬物動態パラメータは以下のとおりであった3)。
用量 5mg 10mg 15mg 例数 10 10 10 Cmax(pg/mL) 186.8±87.1 386.4±215.4 389.7±103.6 AUC0-∞(pg・h/mL) 837.8±572.9 1272.5±656.2 1632.2±475.8 Tmax(h) 1.8±1.6 1.9±1.6 1.8±0.6 t1/2(h) 3.3±3.1 2.5±1.5 3.2±1.5 平均値±標準偏差
16.2 吸収
16.2.1 食事の影響
日本人慢性便秘患者60名を対象に、クロスオーバー法で、本剤単回経口投与後の食事摂取の有無による薬物動態への影響を評価した。食前投与時のCmax及びAUC0-∞は、食事非摂取時の約20~30%であった3)。
【参考資料】
1) EAファーマ株式会社:社内資料(胆汁酸トランスポーターに対する作用)(2018年1月19日承認、申請資料概要2.6.2.2)
2) EAファーマ株式会社:社内資料(胆汁酸吸収に対する作用)(2018年1月19日承認、申請資料概要2.6.2.2)
3) EAファーマ株式会社:社内資料(慢性便秘患者を対象とした臨床薬理試験)(2018年1月19日承認、申請資料概要2.7.2.2)2025年11月改訂
薬効薬理
-
グーフィス®の作用機序は?
特殊患者
-
グーフィス®は肝機能障害患者に対して効果が期待できますか?
電子添文に以下の記載があります。
9. 特定の背景を有する患者に関する注意
9.3 肝機能障害患者
9.3.1 重篤な肝障害のある患者
胆道閉塞や胆汁酸分泌が低下している患者等では本剤の効果が期待できない場合がある。
重篤な肝疾患を合併する患者に関しては、重度の肝機能低下や胆道系の障害等により胆汁酸の小腸への分泌が低下している可能性があるため、本剤の作用が減弱するおそれがあり、特に胆道閉塞等、小腸への胆汁酸の分泌がほとんどない患者では、本剤の効果が期待できない場合があるため注意喚起しています1)。
肝機能障害患者への投与については処方医の判断になります。【参考資料】
1) グーフィス®錠5mg インタビューフォーム Ⅷ. 安全性(使用上の注意等)に関する項目
6. 特定の背景を有する患者に関する注意 (3)肝機能障害患者2025年11月作成
-
グーフィス®は胆嚢切除患者に対して効果が期待できますか?
国内開発時には、胆嚢切除患者は対象から除外されており、有効性・安全性に関するデータはありません。
しかし、胆嚢は肝臓で生成された胆汁をいったん貯えておく臓器であり、胆嚢を切除しても胆汁は肝臓から小腸へ流れ出ること、胆嚢を切除してから6ヵ月以上経過した患者(n=5)においても食事の刺激で胆汁酸は分泌されているとの報告1)があることから、胆嚢切除患者でも本剤の効果は期待できると考えられますが、処方医の判断になります。
なお、重篤な肝障害のある患者(胆道閉塞や胆汁酸分泌が低下している患者等)では本剤の効果が期待できない場合があります(『Q グーフィス®は肝機能障害患者に対して効果が期待できますか?』参照)。電子添文抜粋
9. 特定の背景を有する患者に関する注意
9.3 肝機能障害患者
9.3.1 重篤な肝障害のある患者
胆道閉塞や胆汁酸分泌が低下している患者等では本剤の効果が期待できない場合がある。
【参考資料】
1) Schalm SW, et al. Gut 1978; 19: 1006-142025年11月改訂
-
グーフィス®を透析患者へ投与する際、減量が必要ですか?
透析患者も含めた重篤な腎不全患者に対する臨床試験は行っておりません。なお、日本人慢性便秘患者を対象にした検討では、累積尿中排泄は0.01%程度であり、ほとんどが糞便中に排泄されます。従って、電子添文にも透析患者に対する記載はありません。
参考までに以下の報告があります。
慢性便秘症を合併する血液透析患者に対するグーフィス®錠5mgの有効性及び安全性 -後ろ向き観察研究1)
対象:6ヵ月以上血液透析を受けた維持透析患者のうち、RomeIV基準により機能性便秘症※と診断されグーフィス®10mgを1日1回食前投与(症状に応じて1日5~15mgに調整)された患者※※23例※器質性便秘の疑いのある患者を除外
※※グーフィス®錠5mg【効能又は効果】慢性便秘症(器質的疾患による便秘を除く)
副作用は21.7%(5/23例)に認められ、下痢21.7%(5/23例)、腹痛8.7%(2/23例)、嘔気4.3%(1/23例)でした。本研究において発現した副作用はすべて軽度であり、投与中止に至った副作用の発現は認められませんでした。副作用のため減量を必要とした患者は下痢を発現した1例でした。すべての患者が副作用の発現から1週間以内に回復しました。
電子添文抜粋
16.5 排泄
日本人慢性便秘患者に本剤を絶食下で単回経口投与した時、投与144時間後までの累積尿中薬物排泄率は投与量の0.01%程度であり、尿中への薬物の排泄はほとんど認められなかった。
外国人健康成人男性6名に14C-エロビキシバット5mg(約2.75MBq)を単回経口投与したとき、投与144時間後の糞便中には投与量の103.1%の放射能が排泄され、尿中には投与量の0.00~0.02%の放射能が排泄された。【参考資料】
1) Shono T, Hyakutake H. Renal Replacement Therapy 2020; 6: 21 (著者に持田製薬株式会社及びEAファーマ株式会社から研究費を受領したものが含まれる。当研究は持田製薬株式会社、EAファーマ株式会社の支援にて行われた。)2025年11月改訂
-
グーフィス®の妊婦への投与の安全性は?
妊婦に対する臨床試験を実施していないため、安全性が確立していません。なお、電子添文には、「妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験(ラット)で大量経口投与により、母体毒性(1000mg/kg/日)並びに出生児の生存性、成長及び発達に影響(350mg/kg/日以上)がみられた。」と記載しています。
参考
Ⅷ. 安全性(使用上の注意等)に関する項目
6. 特定の背景を有する患者に関する注意
(5) 妊婦
<参考>
・生殖発生毒性
ラットの受胎能及び胚・胎児発生に関する試験、ラットの出生前及び出生後の発生並びに母体の機能に関する試験及びウサギの胚・胎児発生に関する試験より、受胎能及び胚・胎児発生に対するエロビキシバットの影響は認められず、無毒性量から広い安全マージンが担保されており、臨床における安全性上の懸念はないと考えられた。しかし、ラットの出生前及び出生後の発生並びに母体の機能に関する試験では、1000mg/kg/日のF0母動物において、妊娠末期から授乳初期にかけて体重増加抑制又は体重減少、摂餌量の減少、一般症状の変化(円背位、糞便異常、立毛など)、哺育行動の低下が認められ、F1出生児においては、1000mg/kg/日で授乳初期の一般症状の変化(接触冷感、緩徐呼吸、乳汁未摂取)、多数の出生児死亡(生後0~5日に10腹の全同腹児死亡)、生存率及び哺育率の低下、発育分化完了までの日数の遅延及び静的正向反射成功率の低下、350mg/kg/日以上で授乳期間の体重増加量の低下が認められたため、妊婦への投与に際しての注意として設定した1)。電子添文抜粋
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験(ラット)で大量経口投与により、母体毒性(1000mg/kg/日)並びに出生児の生存性、成長及び発達に影響(350mg/kg/日以上)がみられた。【参考資料】
1) グーフィス®錠5mg インタビューフォーム Ⅷ. 安全性(使用上の注意等)に関する項目 6. 特定の背景を有する患者に関する注意 (5)妊婦2025年11月改訂
-
グーフィス®は授乳婦に投与できますか?
授乳婦に対する臨床試験を実施していないため、安全性が確立していません。なお、電子添文には、「治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。14C-エロビキシバットを用いた動物実験(ラット)で、放射能の乳汁中への移行が報告されている。」と記載しています。
参考
Ⅷ. 安全性(使用上の注意等)に関する項目
6. 特定の背景を有する患者に関する注意
(6) 授乳婦
<参考>
・乳汁への移行
分娩10日後の哺育中雌ラットに14C-エロビキシバットを50mg/kgの用量で単回経口投与したとき、乳汁中への放射能の移行が認められたため授乳婦への投与に際しての注意として設定した。乳汁中への放射能の移行性は血漿中濃度を大きく上回ることはなく、同程度かそれ以下であった1)。Ⅶ. 薬物動態に関する項目
5. 分布
(3) 乳汁への移行性
14C-エロビキシバットを50mg/kgの用量で分娩10日後の哺育中雌ラットに単回経口投与したとき、血漿中放射能濃度は投与2時間後にCmax(443ng eq./mL)を示した後、11.3時間のt1/2で減少した。一方、乳汁中放射能濃度は投与8時間後にCmax(130ng eq./mL)を示した後、7.60時間のt1/2で減少し、乳汁中放射能濃度は血漿中放射能濃度と比較して緩やかに増加する傾向が認められた。乳汁中放射能濃度が血漿中放射能濃度を上回った時点は投与8時間後(血漿中濃度の1.30倍)のみであり、乳汁中放射能濃度は血漿中濃度を大きく上回ることはなく、同程度かそれ以下であった2)。電子添文抜粋
9. 特定の背景を有する患者に関する注意
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。14C-エロビキシバットを用いた動物実験(ラット)で、放射能の乳汁中への移行が報告されている。【参考資料】
1) グーフィス®錠5mg インタビューフォーム Ⅷ. 安全性(使用上の注意等)に関する項目 6. 特定の背景を有する患者に関する注意 (6)授乳婦
2) グーフィス®錠5mg インタビューフォーム Ⅶ. 薬物動態に関する項目 5. 分布 (3)乳汁への移行性2025年11月改訂
相互作用
-
グーフィス®の薬物相互作用とその理由は?
相互作用とその理由は以下の通りです1)。
10. 相互作用
本剤は、P-糖蛋白質の阻害作用を有する2)、3)。[16.7 参照]
10.2 併用注意(併用に注意すること)
薬剤名等 臨床症状・措置方法 機序・危険因子 胆汁酸製剤
ウルソデオキシコール酸、ケノデオキシコール酸これらの薬剤の作用が減弱するおそれがある。 本剤の胆汁酸トランスポーター(IBAT)阻害作用により、胆汁酸製剤の再吸収が阻害されるおそれがある。 アルミニウム含有制酸剤
スクラルファート水和物、アルジオキサ等本剤の作用が減弱するおそれがある。 これらの薬剤は、消化管内で胆汁酸を吸着するため、本剤の作用が減弱するおそれがある。 コレスチラミン、コレスチミド 本剤の作用が減弱するおそれがある。 これらの薬剤は、胆汁酸を吸着するため、本剤の作用が減弱するおそれがある。 ジゴキシン、ダビガトランエテキシラートメタンスルホン酸塩
[16.7 参照]これらの薬剤の血中濃度が上昇し、作用が増強するおそれがある。 本剤のP-糖蛋白質に対する阻害作用による。 ミダゾラム
[16.7 参照]ミダゾラムの血中濃度が低下し、作用が減弱するおそれがある。 機序は不明である。 16.7 薬物相互作用
Caco-2細胞においてP-糖蛋白質の基質であるジゴキシンの輸送に対するエロビキシバットのIC50値は2.65μmol/Lであり、P-糖蛋白質阻害作用を示した2)。
外国人健康成人男女25名を対象に本剤10mgを1日1回5日間経口投与し、ダビガトランエテキシラート150mg/回/日を1日目に、ミダゾラム2mg/回/日を1日目及び5日目に併用して、それぞれの単独投与時と比較した。その結果、P-糖蛋白質の基質であるダビガトランのAUC0-t及びCmaxは、単独投与時と比較してそれぞれ1.17倍(90%信頼区間:1.00-1.36)、1.13倍(90%信頼区間:0.96-1.33)であり、90%信頼区間の上限値がいずれも基準値の1.25を超えた。ミダゾラム5日目のAUC0-t及びCmaxは、単独投与時と比較してそれぞれ0.78倍(90%信頼区間:0.73-0.83)、0.94倍(90%信頼区間:0.87-1.01)であり、AUC0-tの90%信頼区間の下限値が基準値0.80を下回った3)。[10.、10.2 参照]【参考資料】
1) グーフィス®錠5mg 電子添文
2) EAファーマ株式会社: 社内資料(トランスポーターに関する検討)(2018年1月19日承認、申請資料概要2.7.2.2)
3) EAファーマ株式会社:社内資料(薬物相互作用の検討)(2018年1月19日承認、申請資料概要2.7.2.2)2025年11月改訂
-
グーフィス®は脂溶性の栄養素等の吸収に影響しますか?
グーフィス®は回腸における胆汁酸の再吸収を阻害することから、長期投与時には循環する胆汁酸の量の減少等により、脂溶性の栄養素等の吸収に影響を与える可能性が否定できなかったため、国内長期投与試験にて脂溶性ビタミンであるビタミンA、ビタミンD(25(OH)D)及びビタミンE、並びにビタミンKが関与する凝固系の指標(PT、APTT)について変動の有無を確認しましたが、臨床的に問題となるような変動は認められませんでした1)。
【参考資料】
1) グーフィス®錠5mg 審査報告書 7. 臨床的有効性及び臨床的安全性に関する資料並びに機構における審査の概略
7.R 機構における審査の概略 7.R.2 安全性について 7.R.2.5 脂溶性ビタミンへの影響について2025年11月作成
安全性
-
グーフィス®の国内長期投与試験において発現頻度が高かった、腹痛、下痢、下腹部痛、腹部膨満の副作用の発現時期は?
国内長期投与試験における主な副作用の初回発現時期は下表の通りでした。
治験薬の服薬開始日を1日目とし、28日間ごとに区分して、副作用の初回発現の時期別例数と発現率を確認したところ、服薬初期(28日又は56日目まで)には腹痛、下痢、下腹部痛及び腹部膨満が2%以上の発現率を示しましたが、その後は2%を超える副作用は認められませんでした1)。主な副作用の初回発現時期別例数と発現率
例(%)
投与期間 腹痛 下痢 下腹部痛 腹部膨満 ~28日 54(15.9) 28(8.2) 16(4.7) 7(2.1) ~56日 8(2.4) 4(1.2) - 1(0.3) ~84日 5(1.5) 5(1.5) - - ~112日 2(0.6) 4(1.2) - 1(0.3) ~140日 4(1.2) 4(1.2) - 1(0.3) ~168日 3(0.9) - - - ~196日 3(0.9) 1(0.3) - 1(0.3) ~224日 - - - - ~252日 - 1(0.3) - - ~280日 1(0.3) - - - ~308日 - 1(0.3) - - ~336日 2(0.6) 2(0.6) 1(0.3) - 337日~ - - - - -:副作用発現無
【参考資料】
1) グーフィス®錠5mg インタビューフォーム Ⅴ. 治療に関する項目 5. 臨床成績 (4)検証的試験 2)安全性試験2025年11月作成
-
グーフィス®の国内長期投与試験で、腹痛、下痢の有害事象が発現した際は、どのような処置をし、転帰はどうなりましたか?
国内長期投与試験において高頻度に発現した有害事象の「腹痛」及び「下痢」に対する治験薬の処置及び転帰は下表の通りでした1)。
腹痛は85例126件にみられ、治験薬の処置の内訳は、増量1/126件、投与量変更なし60/126件、減量48/126件、休薬10/126件、中止7/126件でした。
転帰は、増量では回復1/1件、投与量変更なしでは回復60/60件、減量では回復48/48件、休薬では回復10/10件、中止では回復7/7件であり、いずれの事象も回復しました。
下痢は54例92件にみられ、治験薬の処置の内訳は、投与量変更なし58/92件、減量21/92件、休薬7/92件、中止6/92件でした。
転帰は、投与量変更なしで回復58/58件、減量では回復21/21件、休薬では回復7/7件、中止では回復6/6件であり、いずれの事象も回復しました。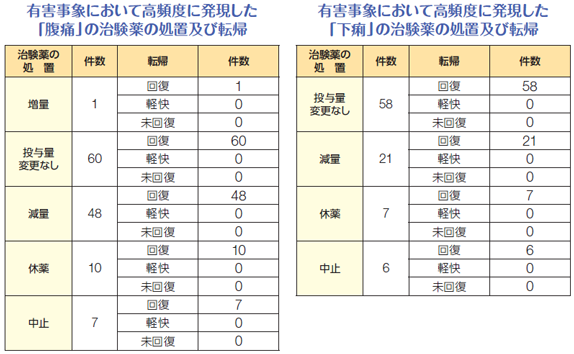
【参考資料】
1) グーフィス®錠5mg 総合製品情報概要 4. 臨床成績 3. 国内長期投与試験 (2)安全性 1)有害事象2025年11月作成
-
グーフィス®の投与で腹痛が発現する機序は?
グーフィス®を投与することで、低下していた大腸の蠕動運動が亢進し、お腹が痛くなることがあります1)。これを、蠕動痛といいます。
なお、国内長期投与試験で発現した腹痛(85例126件)の有害事象の転帰は、増量、投与量変更なし、減量、休薬、中止により、全て回復しています(『Q グーフィス®の国内長期投与試験で、腹痛、下痢の有害事象が発現した際は、どのような処置をし、転帰はどうなりましたか?』参照)2)。【参考資料】
1) 患者様向け資材:グーフィス®錠5mgを服用される患者さんへ(製作物コード:14960)
2) グーフィス®錠5mg 総合製品情報概要 4. 臨床成績 3. 国内長期投与試験 (2)安全性 1)有害事象2025年11月作成
保険
-
未治療の初診患者にグーフィス®を投与しても保険審査上の問題はありませんか?
平成30年11月27日付の「保医発1127第2号」(厚生労働省保険局医療課長)には、グーフィス®錠5mgについて、以下の記載があります。
この通知が各都道府県の審査機関に発出されていますが、未治療患者へのグーフィス®の投与の可否については、この通知を受けた各都道府県の審査機関の判断になります。グーフィス®錠5mg
本製剤の使用に当たっては、他の便秘症治療薬(ルビプロストン製剤、リナクロチド製剤、マクロゴール4000配合製剤及びラクツロース製剤を除く。)で効果不十分な場合に、器質的疾患による便秘を除く慢性便秘症の患者へ使用すること。2025年11月作成
製剤
-
グーフィス®錠は一包化できますか?(無包装での安定性)
無包装状態(PTPシート取り出し後)の安定性試験の結果は以下の通りです1)。
無包装状態での製剤の安定性は、保管状況により変化する可能性がありますので注意してください。
なお、本剤の貯法は「室温保存」です。また、電子添文の「20. 取扱い上の注意」には「アルミ袋開封後は高温、湿気を避けて気密容器に保存すること。」の記載があります。試験 保存条件 保存形態 期間 結果 苛酷試験 温度 50℃/なりゆき湿度 褐色ガラス瓶、気密 3ヵ月 規格内 湿度 25℃/90%RH 褐色ガラス瓶、開栓 3ヵ月 規格内 光 25℃(D65ランプ) シャーレ、開放 120万 lx ・時間 規格内 一包化に関する参考情報をお知りになりたい場合は、持田製薬株式会社 くすり相談窓口にお問合せください。
持田製薬株式会社 くすり相談窓口 医療関係者向けフリーコール:0120-189-522
医療用医薬品に関するお問い合わせ【参考資料】
1) EAファーマ株式会社:社内資料(苛酷試験(無包装)に関する資料)2025年11月改訂
-
グーフィス®錠を粉砕してもいいですか?
粉砕して投与することは、承認された用法ではなく、体内動態や安全性・有効性の検討を行っていないため、適正使用の観点から弊社としては推奨していません。
粉砕に関する参考情報をお知りになりたい場合は、持田製薬株式会社 くすり相談窓口にお問合せください。
持田製薬株式会社 くすり相談窓口 医療関係者向けフリーコール:0120-189-522
医療用医薬品に関するお問い合わせ2025年11月改訂
-
グーフィス®錠の簡易懸濁は可能ですか?
簡易懸濁による投与は、承認された用法ではなく、体内動態や安全性・有効性の検討を行っていないため、適正使用の観点から弊社としては推奨していません。
簡易懸濁に関する参考情報をお知りになりたい場合は、持田製薬株式会社 くすり相談窓口にお問合せください。
持田製薬株式会社 くすり相談窓口 医療関係者向けフリーコール:0120-189-522
医療用医薬品に関するお問い合わせ2025年11月改訂
-
グーフィス®錠を半割してもいいですか?
錠剤には割線がなく、半割後の安定性は検討していません。半割して投与することは承認された用法ではなく、体内動態や安全性・有効性の検討を行っていないため、適正使用の観点から弊社としては推奨していません。
半割の可否については、ご施設のご判断でお願いします。2025年11月改訂