- 医療関係者向けホーム
- フィルグラスチムBS注「モチダ」
- Information:製品管理に関する情報
 Information
Information
製品管理に関する情報
製剤学的事項
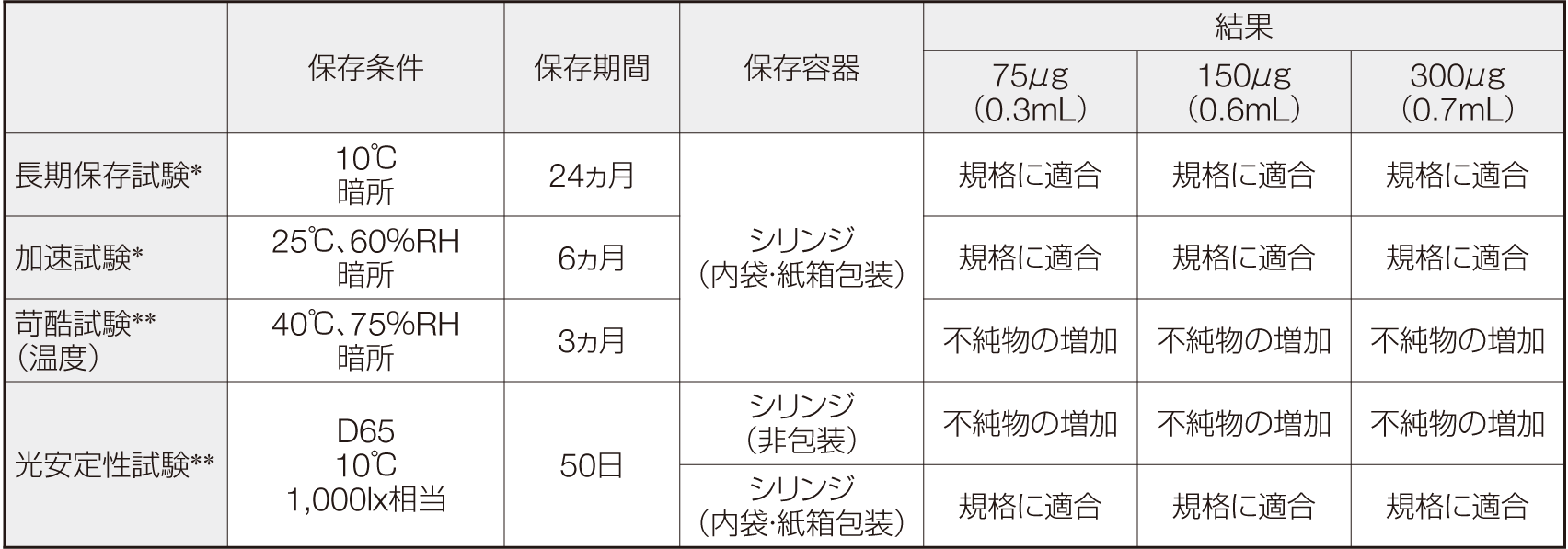
製剤の安定性
取扱い上の注意
- 1.取扱い上の注意
-
- (1)プランジャーロッドの無理な操作はしないこと。
- (2)できるだけ使用直前までピロー包装からシリンジを取り出さないこと。
- (3)シリンジ先端部のトップキャップが外れている、またはシリンジの破損等の異常が認められるときは使用しないこと。
- 2.規制区分:処方箋医薬品注)
-
- 注)注意-医師等の処方箋により使用すること
- 3.貯 法:遮光下、凍結を避け、10℃以下に保存
- 4.使用期限:直接容器及び外箱に表示
包装
フィルグラスチムBS 注75μg シリンジ「モチダ」:1 シリンジ、10 シリンジ
フィルグラスチムBS 注150μg シリンジ「モチダ」:1 シリンジ、10 シリンジ
フィルグラスチムBS 注300μg シリンジ「モチダ」:1 シリンジ、10 シリンジ