- 医療関係者向けホーム
- 消化器領域
- グーフィス®錠5mg
- Clinical Study:国内長期投与試験 安全性
 Clinical Study国内長期投与試験
Clinical Study国内長期投与試験
安全性
1)有害事象
①有害事象発現率
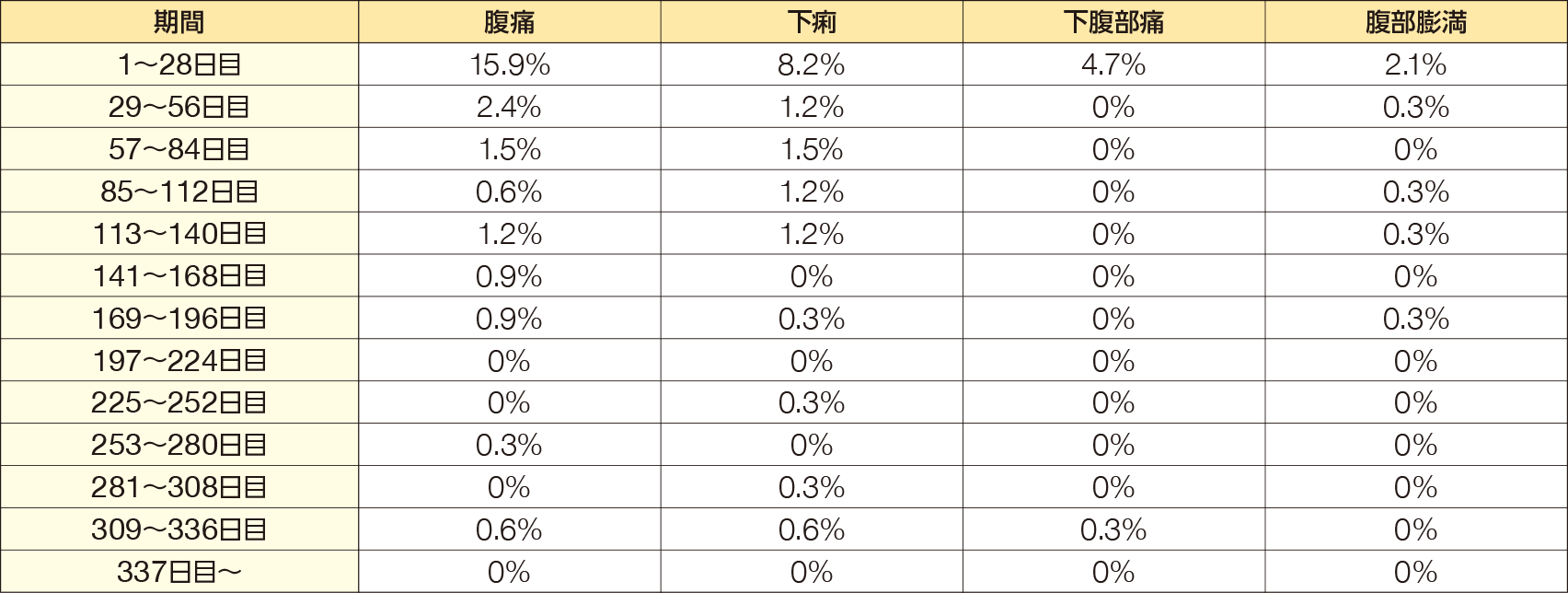
有害事象発現率は77.6%(264/340例)であった。2%以上発現した有害事象は鼻咽頭炎25.6%(87/340例)、腹痛25.0%(85/340例)、下痢15.9%(54/340例)、下腹部痛及び悪心各5.0%(17/340例)、上気道の炎症3.8%(13/340例)、インフルエンザ、腹部膨満及び肝機能検査異常各3.5%(12/340例)、腹部不快感3.2%(11/340例)、咽頭炎2.9%(10/340例)、気管支炎、胃腸炎、上腹部痛及び背部痛各2.6%(9/340例)、湿疹2.4%(8/340例)、齲歯、胃炎、軟便及び血中クレアチンホスホキナーゼ増加各2.1%(7/340例)の20事象であった。
重篤な有害事象は1.5%(5/340例:「くも膜下出血・硬膜下血腫・頭蓋骨骨折・硬膜下ヒグローマ」、「マイコプラズマ性肺炎」、「手根管症候群」、「網膜剥離」及び「鼡径ヘルニア」各1例)に認められた。
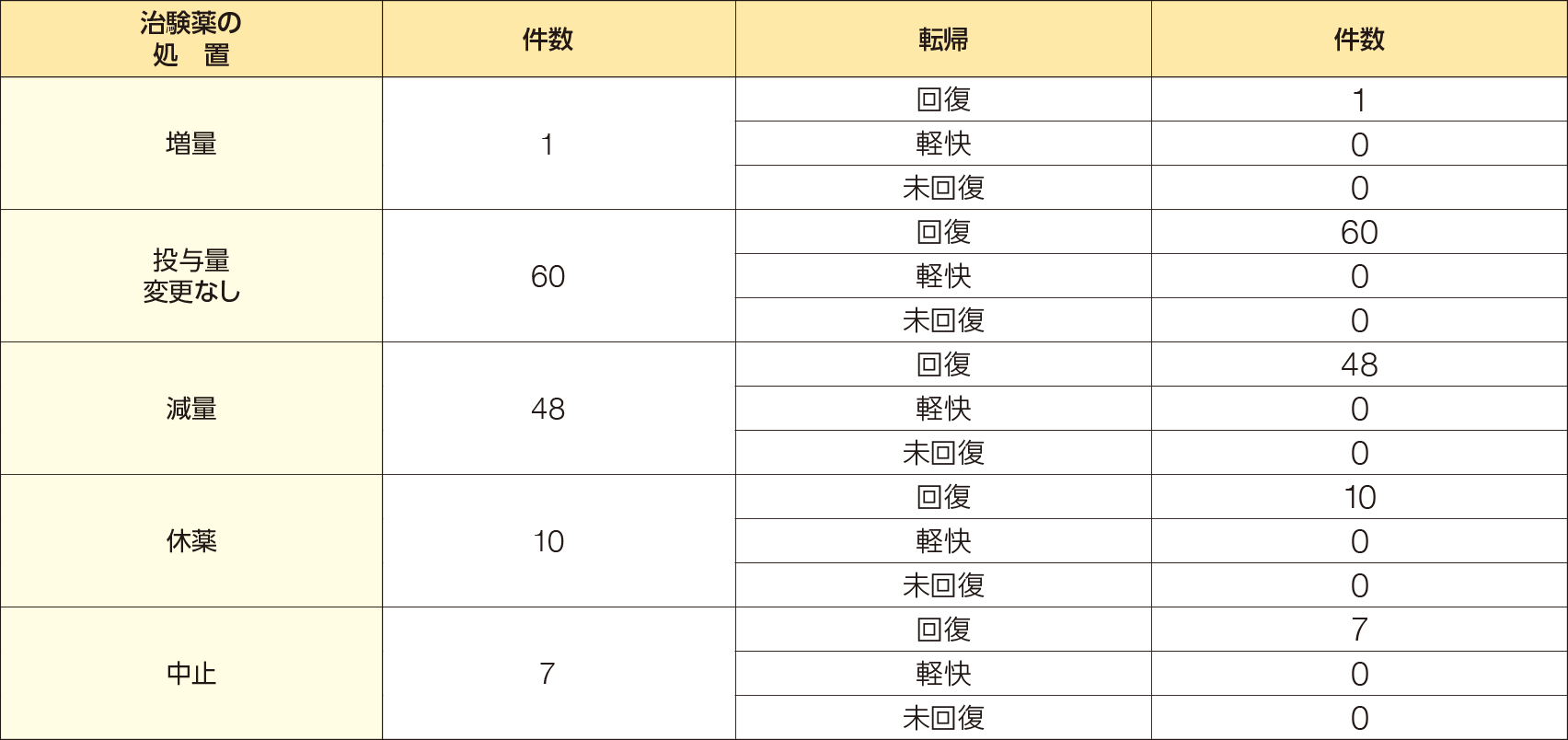
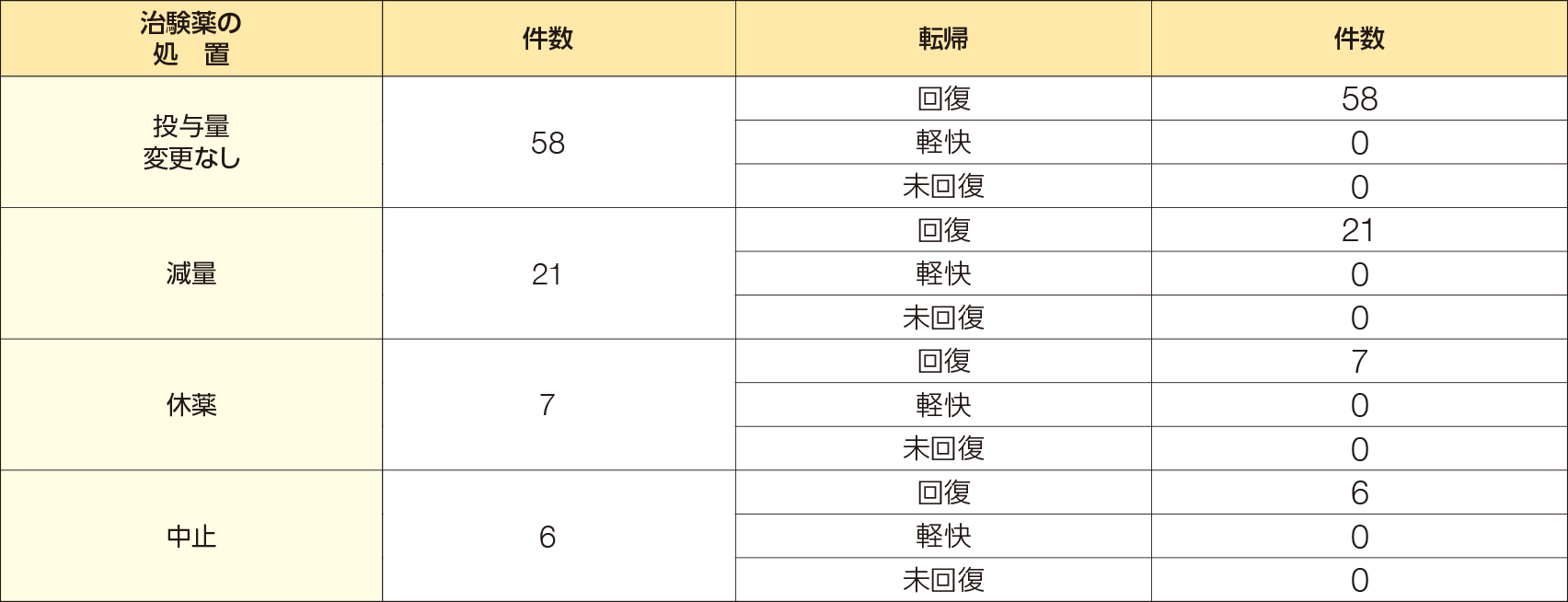
②有害事象において高頻度に発現した「腹痛」及び「下痢」の治験薬の処置及び転帰
腹痛は85例126件にみられ、治験薬の処置の内訳は、増量1/126件、投与量変更なし60/126件、減量48/126件、休薬10/126件、中止7/126件であった。転帰は、増量では回復1/1件、投与量変更なしでは回復60/60件、減量では回復48/48件、休薬では回復10/10件、中止では回復7/7件であり、いずれの事象も回復した。
下痢は54例92件にみられ、治験薬の処置の内訳は、投与量変更なし58/92件、減量21/92件、休薬7/92件、中止6/92件であった。転帰は、投与量変更なしで回復58/58件、減量では回復21/21件、休薬では回復7/7件、中止では回復6/6件であり、いずれの事象も回復した。
2)副作用
①副作用発現率
副作用の発現率は47.9%(163/340例)であった。2%以上発現した副作用は、下表の通りであった。本試験において死亡例は認められなかった。
重篤な副作用として、鼡径ヘルニアが1例1件に発現した。投与中止に至った副作用は18例26件(腹痛7件、下痢6件、腹部膨満、肝機能検査異常 各2件、顔面麻痺、腹部不快感、上腹部痛、鼓腸、鼡径ヘルニア、軟便、発疹、蕁麻疹、末梢性浮腫 各1件)であった。
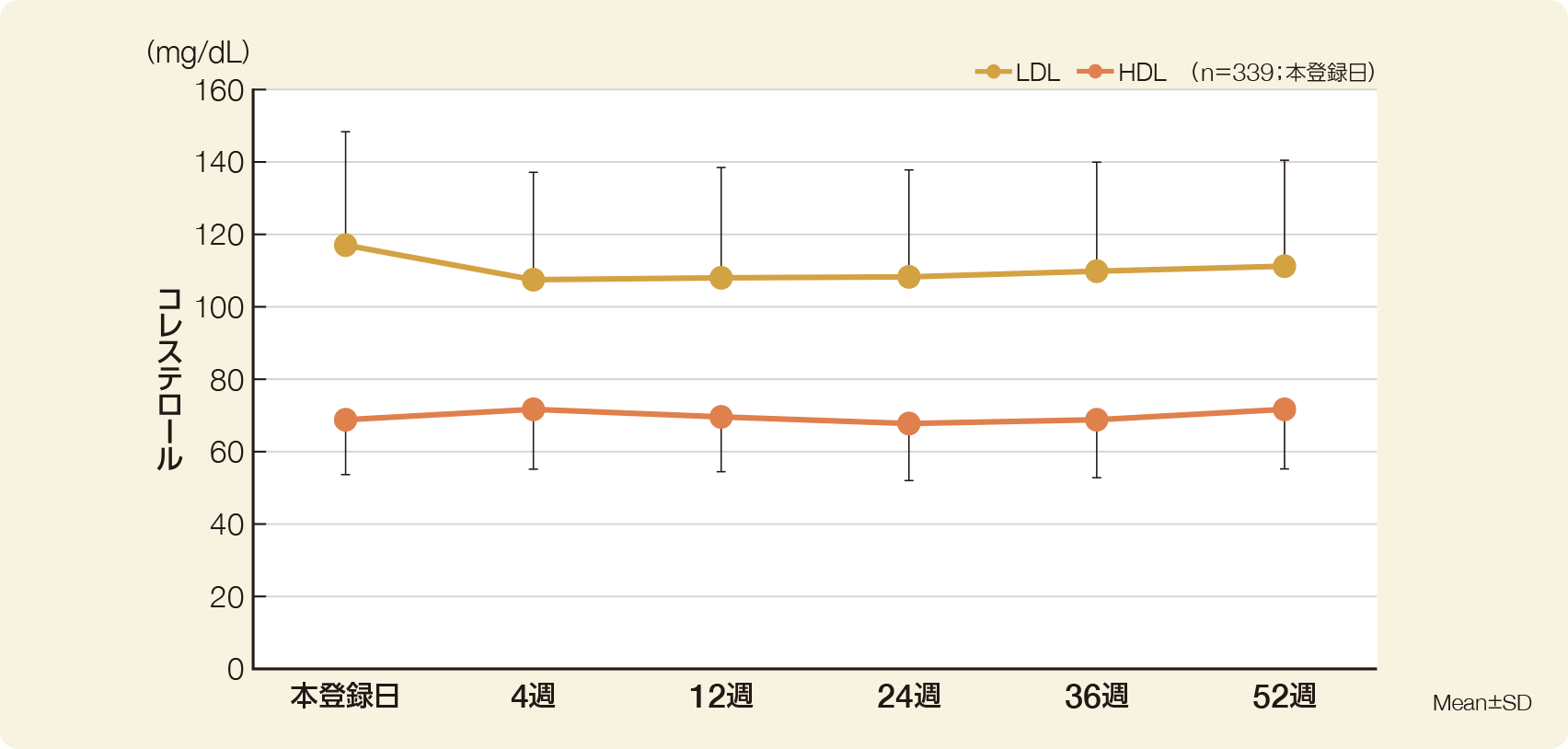
3)臨床検査値
血清LDLコレステロール濃度(Mean±SD)は、本登録日、投与期間第4週、第12週、第24週、第36週、第52週の順に、117.4±31.2mg/dL、107.8±29.4mg/dL、108.3±30.5mg/dL、108.1±30.0mg/dL、109.9±30.5mg/dL、111.2±29.5mg/dLであった。
6. 用法及び用量:通常、成人にはエロビキシバットとして10mgを1日1回食前に経口投与する。なお、症状により適宜増減するが、最高用量は1日15mgとする。