- 医療関係者向けホーム
- 消化器領域
- グーフィス®錠5mg
- Clinical Study:国内長期投与試験 試験の概要
 Clinical Study国内長期投与試験
Clinical Study国内長期投与試験
試験の概要「国内長期投与試験1,2)」
- 〔一部承認外(用法及び用量)の成績が含まれるデータですが、長期投与時の承認時評価資料のため紹介します。〕
- 1)EAファーマ株式会社:社内資料(慢性便秘患者における長期投与時の安全性、有効性の検討)<承認時評価資料>
- 2)Nakajima A, et al.:Lancet Gastroenterol Hepatol 2018;3(8):537-547
(著者にEAファーマ株式会社よりアドバイザー料を受領している者が含まれる。
当研究はEAファーマ株式会社、持田製薬株式会社の支援にて行われた。)
「禁忌を含む注意事項等情報」等は電子添文をご参照ください。
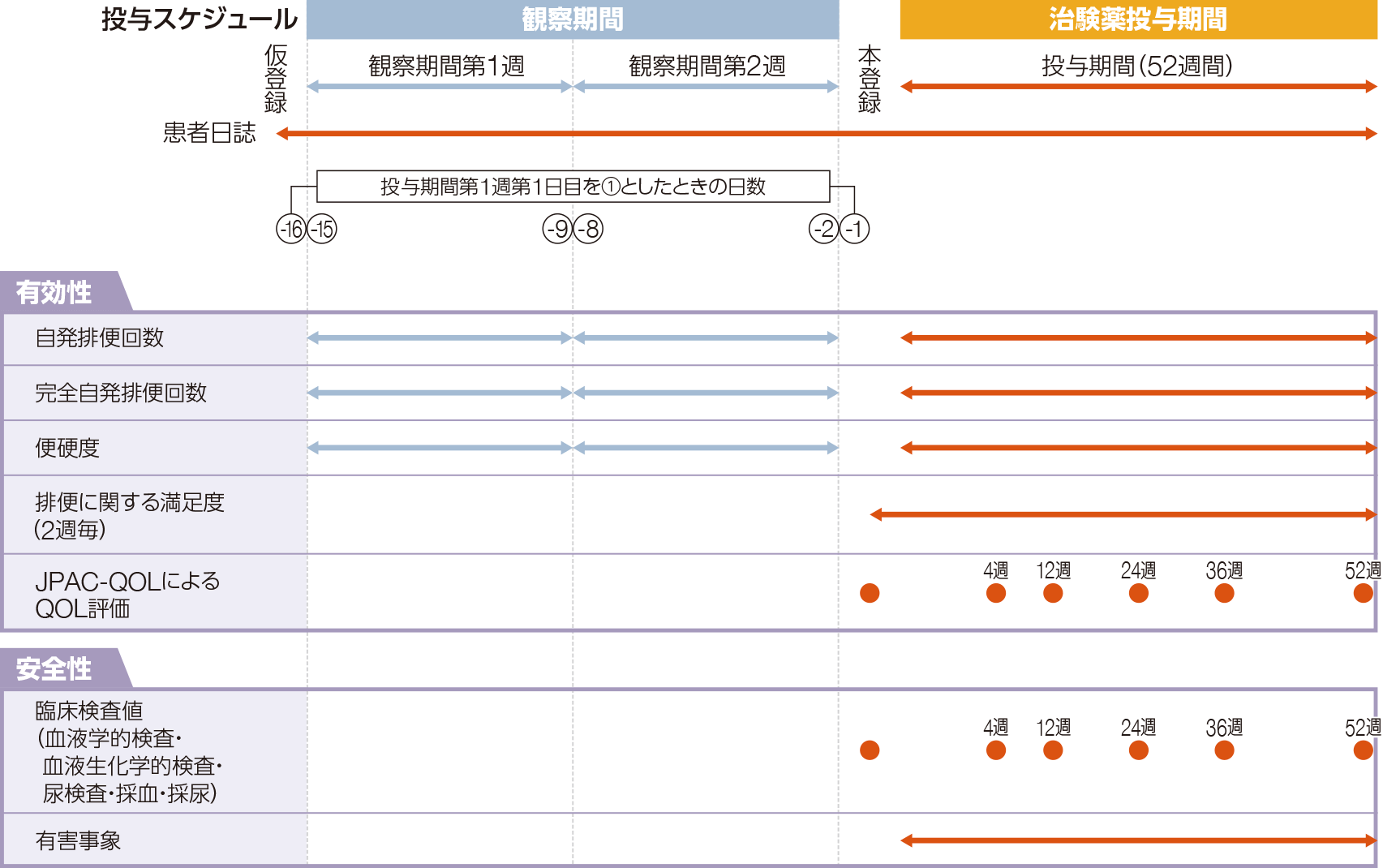
試験デザイン
非盲検多施設共同試験
目的
慢性便秘症患者を対象として、グーフィス®を長期(52週間)投与した際の安全性、有効性を検討することを目的とした。
対象
慢性便秘症患者341例(有効性解析対象〔FAS*〕:340例、安全性解析対象:340例)
RomeⅢの機能性便秘の診断基準を参考として、同意取得時の6ヵ月以上前から自発排便回数が平均3回/週未満であり、かつ自発排便に関連した、①排便の25%以上にいきみがある、②排便の25%以上に兎糞状便又は硬便がある、③排便の25%以上に残便感がある、の3つのうち1つ以上の症状を有している慢性便秘症患者を対象とした。
投与方法
治験薬投与開始前の排便回数の調査期間として2週間の観察期間を設定した後、1日1回朝食前にグーフィス®を52週間経口投与した。初期投与量として10mgを1日1回7日間投与し、それ以降は症状に応じて1日1回、5、10又は15mgの間で適宜増減とした。被験者は定められた時期に来院し、外来で観察・検査等が行われた。
評価項目
<有効性に関する評価項目>
- 観察期間第2週からの変化量と排便回数の推移(自発排便・完全自発排便)
- 投与期間各週の自発排便回数及び完全自発排便回数のレスポンダーの割合
- Bristol便形状スケールに基づいた便硬度
- JPAC-QOLスコアによるQOL評価
- 〈参考情報〉患者の排便に関する満足度
<安全性に関する評価項目>
- 有害事象(発現率、高頻度に発現した「腹痛」及び「下痢」の治験薬の処置及び転帰)
- 副作用(発現率、発現時期)
- 臨床検査値
解析計画
FASを解析対象集団とし、投与期間各週における自発排便回数、完全自発排便回数について要約統計量を算出した。観察期間第2週からの変化量について、要約統計量を算出し、投与期間第4、12、24、36、52週において1標本t-検定を行った。
検証的な解析以外で得られたp値を名目上のp値とした。
| 自発排便 | 下剤/浣腸あるいは摘便なしに発現する排便。本治験においては、観察期間開始3日前から観察期間開始前日までに使用した下剤および救済薬(ビサコジル坐剤10mg)使用後24時間以内の排便は自発排便としない。 |
|---|---|
| 完全自発排便 | 残便感のない自発排便 |
| 排便回数 | 「トイレに入ってから出るまでに生じた排便」を1回とカウントした(例:一度排便し、少し時間があいて再度排便した場合でも、トイレから出ていなければ1回とカウントする)。一方、排便後にトイレを出て再びトイレに入って排便した場合は、別々の排便としてカウントした。 |
| レスポンダー | 1週間あたりの自発排便回数又は完全自発排便回数が、観察期間第2週より1回以上改善し、かつ3回以上である被験者をそれぞれレスポンダーとする。 |
- *FAS:Full Analysis Set (最大の解析対象集団) 治験薬が1回以上投与され、何らかの有効性に関する観測値を持つすべての被験者による集団を「最大の解析対象集団」とした。なお、排便回数の各週の評価可能日が5日未満の場合には、該当週の排便回数は欠測値として扱った。
6. 用法及び用量:通常、成人にはエロビキシバットとして10mgを1日1回食前に経口投与する。なお、症状により適宜増減するが、最高用量は1日15mgとする。