- 医療関係者向けホーム
- その他領域
- ペグフィルグラスチムBS「モチダ」
- Clinical Study:国内第Ⅲ相試験 試験の概要
 Clinical Study国内第Ⅲ相試験
Clinical Study国内第Ⅲ相試験
「禁忌を含む注意事項等情報」等は電子添文をご参照ください。
試験の概要「国内第Ⅲ相試験」
- 持田製薬社内資料:第Ⅲ相試験〔承認時評価資料〕
目的
術前あるいは術後補助療法としてがん化学療法施行予定の乳癌患者を対象に、本剤投与時の安全性及び有効性の検討を行う。
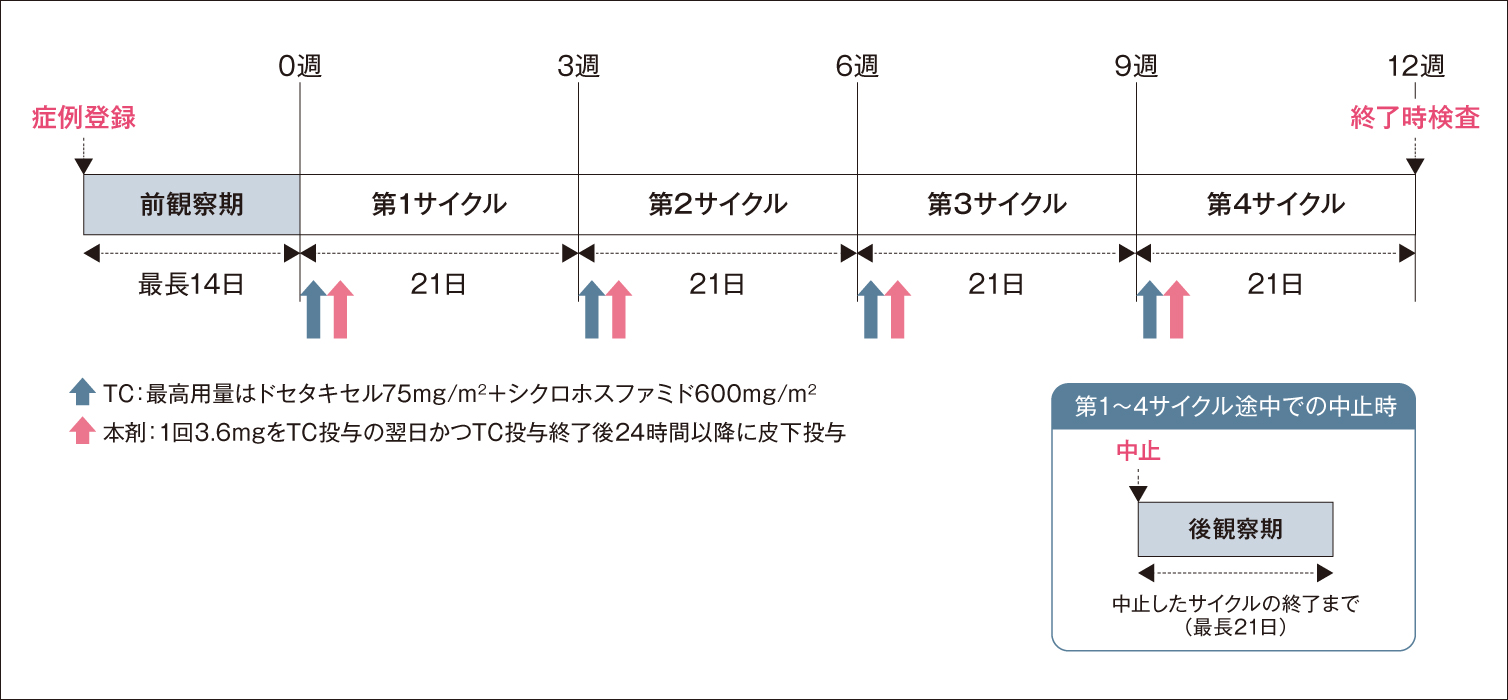
試験デザイン
多施設共同、非盲検、非対照試験
対象
臨床的又は病理学的にStageⅠ~Ⅲの原発性浸潤性乳癌と診断され、術前又は術後がん化学療法としてドセタキセル+シクロホスファミド(TC)療法を4サイクル実施予定でECOG PS2※以下の女性患者(投与例数:101例)
- ※ ECOG:Eastern Cooperative Oncology Group、PS:Performance Status
方法
TC療法各サイクルにおいて、本剤3.6mgをTC投与の翌日かつTC投与終了後24時間以降に1回皮下投与した。TC療法は、21日間を1サイクルとして4サイクル施行した(本剤は合計4回投与した)。
TC療法の最高用量は、ドセタキセルとして75mg/m2、かつシクロホスファミドとして600mg/m2とし、第1サイクルの減量は許容しなかった。第1サイクルの減量が必要な場合、治験を中止することとした。
評価項目
有効性に関する評価項目
【主要評価項目】
第1サイクルにおける有害事象共通用語規準 日本語訳JCOG 版(CTCAE)v5.0のGrade 4の高度好中球数減少(ANC<500/μL)の日数(DSN)
【副次評価項目】
全サイクルを通じたFN発現率※、第1サイクルにおけるFN発現率※
- ※ ANC<500/μLが確認された日±1日の範囲に37.5℃(腋窩温)以上の発熱が認められた場合にFNの発現ありとした。
安全性に関する評価項目
有害事象(副作用)、バイタルサイン、臨床検査、免疫原性(抗薬物抗体が陽性の場合、中和抗体を測定する)
解析計画
有効性に関する評価項目
TC療法第1サイクルに治験薬を投与され、かつ治験薬投与後に一度でもANCが測定された被験者(FAS)を、有効性の主要な解析対象集団とした。
第1サイクルにおけるANC<500/μLの日数(DSN)を集計し、DSNの要約統計量及び平均値の両側95%信頼区間を算出した。
安全性に関する評価項目
TC療法第1サイクルに治験薬を投与され、かつ治験薬投与後に安全性の評価に関するデータがある被験者を、安全性解析対象集団とした。
治験薬初回投与後第1サイクル及び全サイクルを通じ、有害事象と副作用の発現率を算出した。なお、有害事象の集計はICH国際医薬用語集日本語版(MedDRA/J)(Ver.24.0)の基本語(PT)を用いて行った。
また、バイタルサイン、臨床検査値、免疫原性について解析した。