- 医療関係者向けホーム
- 循環器領域
- エパデールEM
- Clinical Study:国内第Ⅲ相長期投与試験 試験概要
 Clinical Study国内第Ⅲ相長期投与試験
Clinical Study国内第Ⅲ相長期投与試験
試験概要「国内第Ⅲ相長期投与試験」
- 持田製薬社内資料:国内第Ⅲ相検証試験(MND2119H41試験)<2022年6月20日承認、CTD 2.7.6.5>[承認時評価資料]
「禁忌を含む注意事項等情報」等は電子添文をご参照ください。
目的
高脂血症(TG高値)患者を対象に、エパデールEMを長期投与した際の安全性および有効性を検討する。
対象
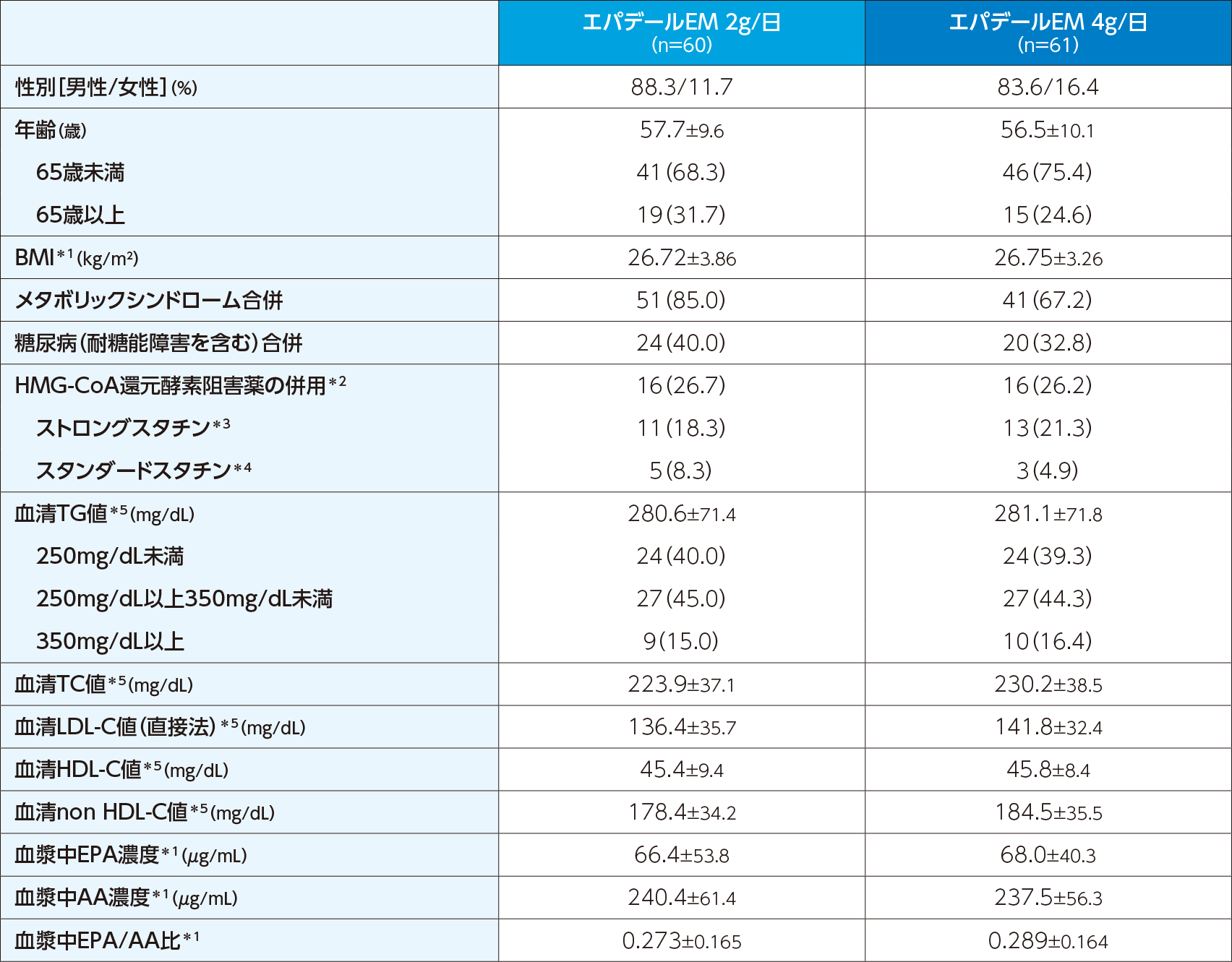
生活習慣の改善指導を受けている高脂血症(TG高値)患者122例
- <選択基準>
-
- 同意取得時の年齢:20歳以上~75歳未満
- 前観察期の空腹時血清TG値150mg/dL以上500mg/dL未満(投与開始前4週時、2週時)
本試験では前観察期および投与期にスタンダードスタチン(シンバスタチン、プラバスタチンナトリウム、フルバスタチンナトリウム)およびストロングスタチン(アトルバスタチンカルシウム水和物、ピタバスタチンカルシウム水和物、ロスバスタチンカルシウム)、β遮断薬、糖尿病治療薬の併用は、1日処方量の変更、薬剤の追加および変更がない限り可としたが、スタチン以外の高脂血症治療薬、インスリン、エストロゲン、副腎皮質ホルモン(全身投与用)、レチノイド(外用剤を除く)、サイアザイド、インターフェロンの併用は不可とした。
試験デザイン
第Ⅲ相、多施設共同、ランダム化、非盲検試験
投与方法
前観察期の評価で適格と判断された患者を、エパデールEM 2g/日群、4g/日群に1:1の割合で割り付け、それぞれエパデールEM 2g、4gを1日1回朝食直後に52週間経口投与した。
評価項目
◎主要評価項目
投与開始時以降の有害事象
◎副次評価項目
- <安全性>
-
投与開始時以降の副作用
- <有効性>
-
以下の項目に関する推移および投与前値※からの変化率の推移
- ・血清TG値
- ・血清総コレステロール(TC)値
- ・血清低比重リポ蛋白コレステロール(LDL-C)値(直接法)
- ・血清高比重リポ蛋白コレステロール(HDL-C)値
- ・血清non HDL-C値
◎その他の評価項目
血漿中イコサペント酸(EPA)濃度、血漿中アラキドン酸(AA)濃度、血漿中EPA/AA比の推移
投与52週後または投与終了時(LOCF; Last Observation Carried Forward)における血漿中EPA/AA比1.0以上の達成率 など
解析計画
安全性解析対象集団は治験薬が1回以上投与され、安全性の評価に関するデータが1つ以上ある患者、有効性の主要な解析対象集団は最大の解析対象集団(FAS)とした。
◎主要評価項目
投与群ごとに、投与開始時から後観察期の調査終了までに発現した有害事象の発現率を算出した。なお、エパデールEMの有効成分〔イコサペント酸エチル(EPA-E)〕は、抗血小板作用を有することから出血関連有害事象も集計した。
◎副次評価項目
- <安全性>
- 投与群ごとに、投与開始時から後観察期の調査終了までに発現した副作用の発現率を算出した。有害事象と同様に出血関連副作用も集計した。
- <有効性>
- 投与群ごと、評価時期ごとに要約統計量および平均値の95%信頼区間を算出した。投与終了時の結果はLOCFで補完した。投与前値※およびHMG-CoA還元酵素阻害薬(ストロングスタチン)併用の有無を共変量とした共分散分析を行い、投与12週後、24週後、52週後、終了時における変化率を群間比較した。
◎その他の評価項目
投与群ごと、評価時期ごとに要約統計量および平均値の95%信頼区間を算出した。投与終了時の結果はLOCFで補完した。また、EPA/AA比1.0以上の達成率に関して、事前に規定された投与開始時のEPA/AA比別のサブグループ解析を実施した。
- ※ 投与開始前4週時、2週時および投与開始時の測定値の平均値