- 医療関係者向けホーム
- 循環器領域
- ユリス®錠
- Pick Up
- かかりつけ医のための尿酸コントロールのポイント(テキスト版)
 Pick Up
Pick Up
2021年04月22日公開(2022年10月11日一部改訂)
高尿酸血症は、尿酸の産生と排泄のバランスが崩れて、体内の尿酸が過剰になった状態であり、その治療においては尿酸コントロールが重要です。2020年5月、痛風、高尿酸血症の治療選択肢の一つとして選択的尿酸再吸収阻害薬(SURI)であるユリス®錠(ドチヌラド)が加わりました。
今回は、高尿酸血症の病型や管理目標、そしてドチヌラドのSURIとしての特徴を踏まえた尿酸コントロールについて、米子医療センターの久留一郎先生に伺いました。

久留 一郎先生
- 高尿酸血症の定義と病型分類
- 痛風と心血管疾患との関係
- 高尿酸血症の管理目標値
- 尿酸コントロールにおけるURAT1の重要性とドチヌラドの特徴
- ドチヌラドの臨床効果
- COVID-19に関連した高尿酸血症・痛風患者へのアプローチのポイント
- おわりに
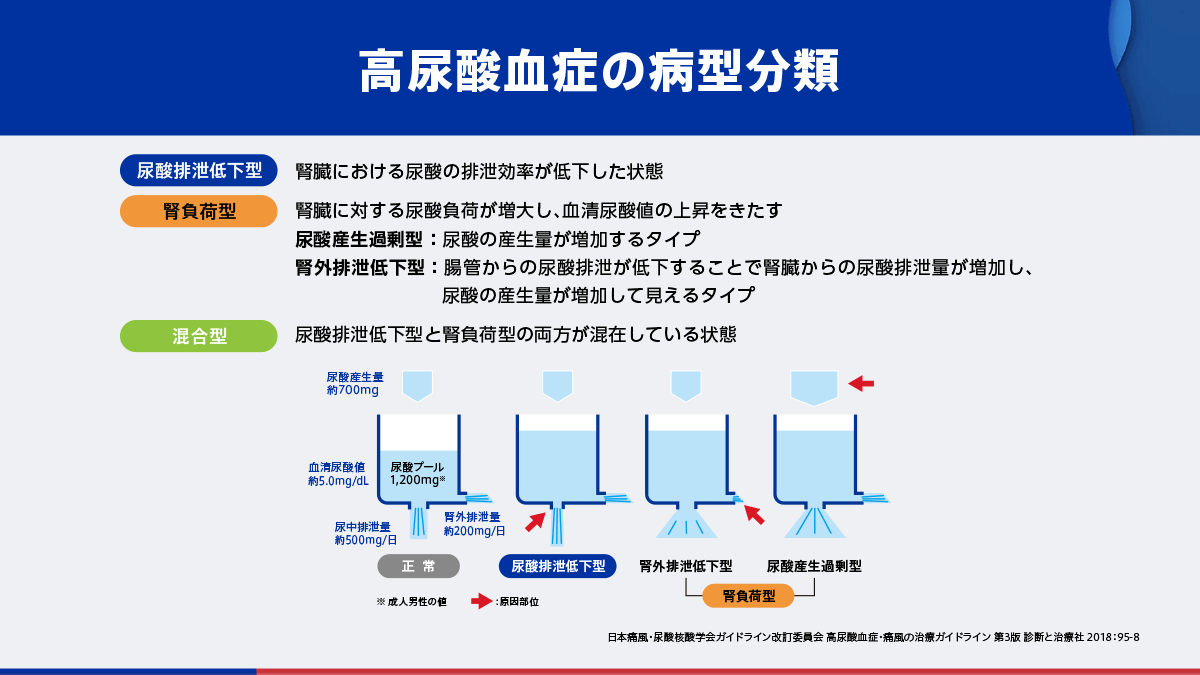
高尿酸血症の定義と病型分類
高尿酸血症は、「尿酸塩沈着症(痛風関節炎、腎障害など)の病因であり、性別、年齢を問わず、血清尿酸値が7.0mg/dLを超えるもの」と定義されています1)。これは、この値を超えると尿酸一ナトリウム(MSU)の結晶が析出し、痛風関節炎のリスクが高まるためです。
- 1)日本痛風・尿酸核酸学会ガイドライン改訂委員会 高尿酸血症・痛風の治療ガイドライン 第3版 診断と治療社 2018 : 72-3
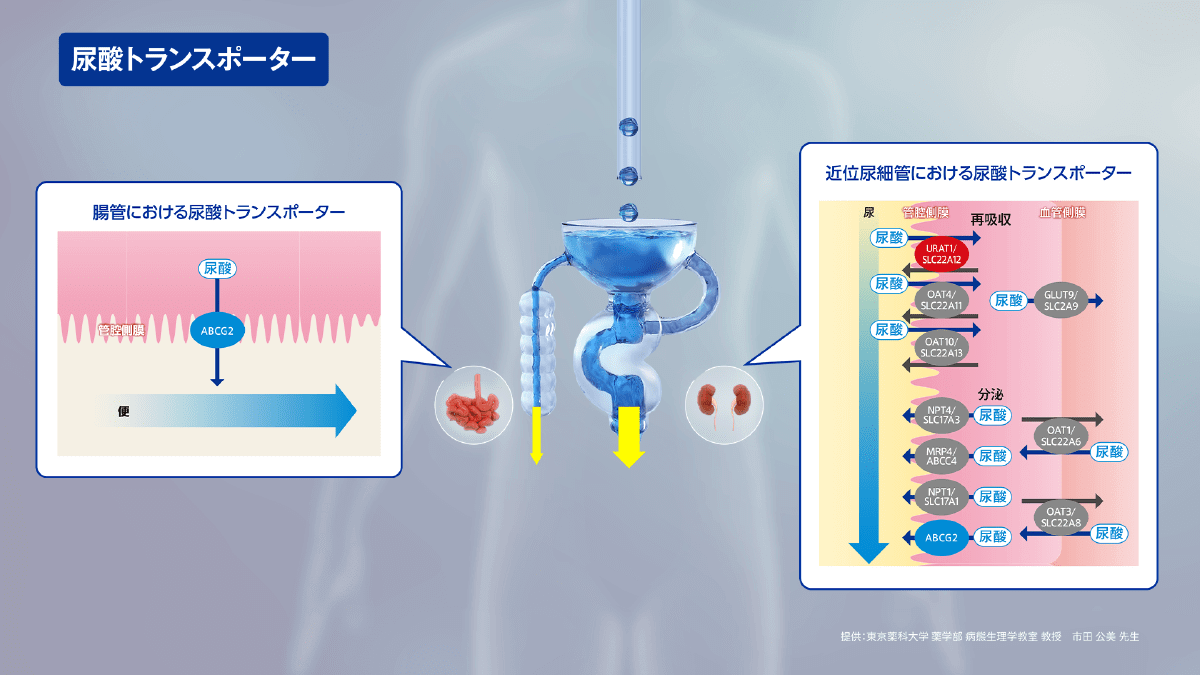
尿酸の排泄には様々なトランスポーターが関与しています。尿酸の再吸収には、主に近位尿細管細胞の尿細管管腔側に存在するURAT1や、血管側に存在するGLUT9が関与しています。一方、尿酸の分泌には、主に尿細管管腔側に存在するABCG2が関与しています。
また、ABCG2は腸管にも発現し、尿酸を便中に排泄しています。
これらの尿酸トランスポーターの働きは、高尿酸血症の発症とも関係すると考えられています。
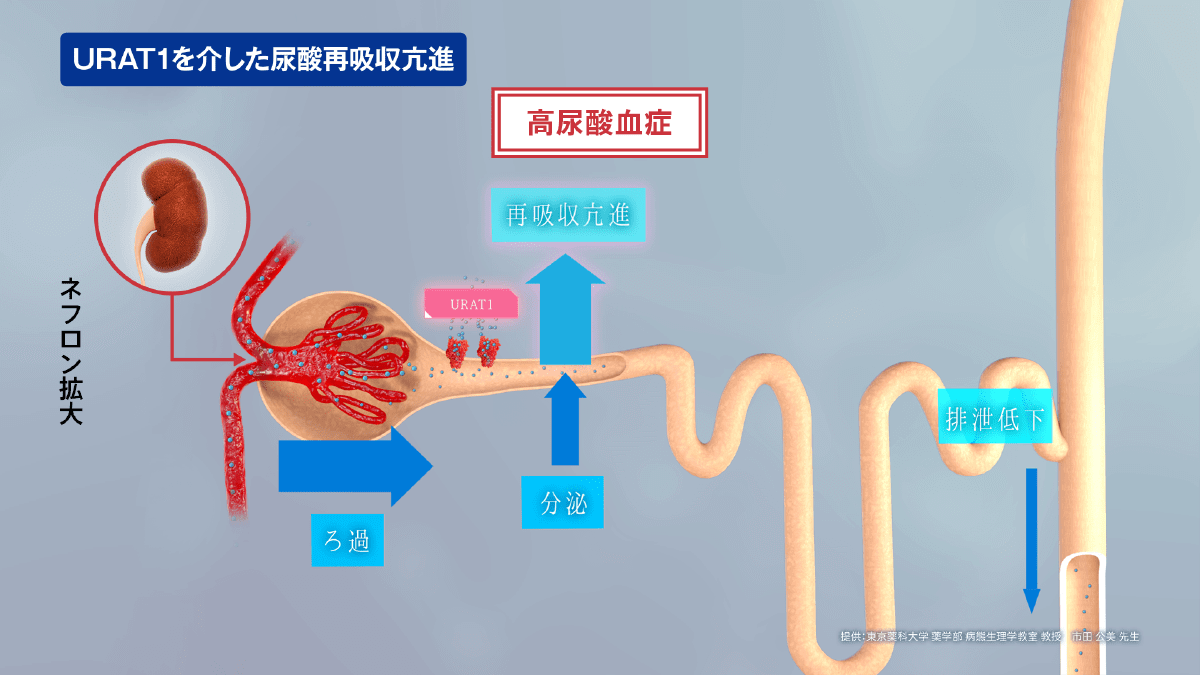
例えば、URAT1を介した尿酸再吸収が何らかの原因で亢進すると、血中尿酸が増加し、高尿酸血症の病態をきたす要因の1つになると考えられています。
また、近年、ABCG2の機能低下により腸管からの尿酸排泄が低下することで高尿酸血症に至ることも明らかになっています。
痛風と心血管疾患との関係
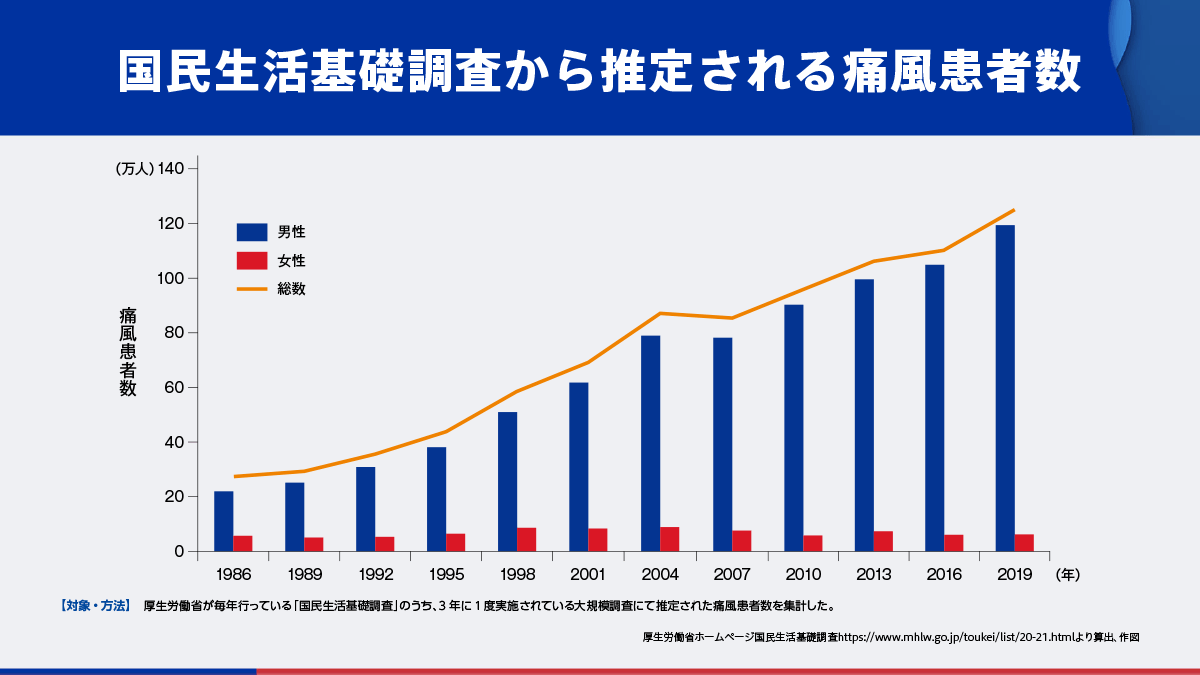
わが国の痛風患者数は増加傾向にあり、2019年時点では推定125万人とされています3)。
- 3)厚生労働省ホームページ 国民生活基礎調査 https://www.mhlw.go.jp/toukei/list/20-21.html
高尿酸血症の管理目標値
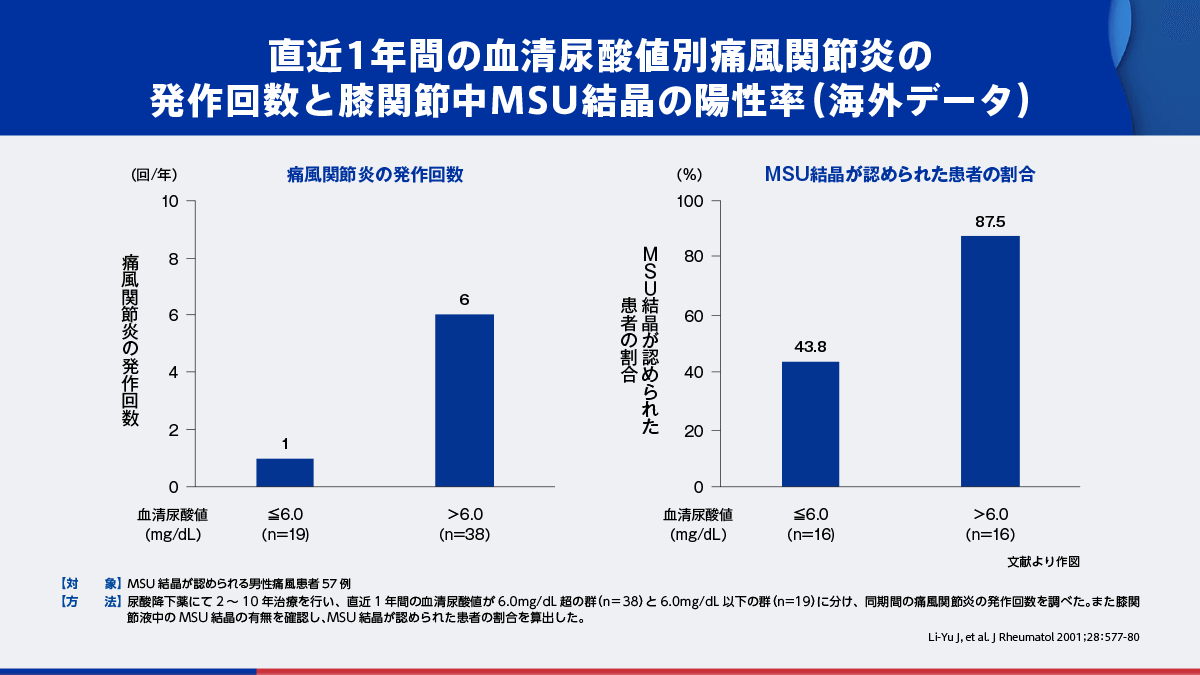
痛風関節炎や痛風結節の既往を有する患者における管理目標値に関するエビデンスの一例をご紹介します。
こちらは、男性痛風患者を対象とした海外の前向き調査の結果です5)。直近1年間の血清尿酸値が6.0mg/dL以下を維持していた群では痛風関節炎発作回数が平均1回であったのに対し、6.0mg/dLを超えていた群では平均6回でした。また、観察終了時にMSU結晶が認められた患者の割合は、それぞれ43.8%、87.5%でした。
- 5)Li-Yu J, et al. J Rheumatol 2001 ; 28 : 577-80
高尿酸血症・痛風の治療ガイドライン第3版では、「痛風関節炎を繰り返す患者や痛風結節を認める患者は薬物治療の適応となり、血清尿酸値を6.0mg/dL以下に維持するのが望ましい。」とされています6)。
一方、合併症を有する場合の無症候性高尿酸血症の管理目標値について、コンセンサスは得られていないのが実情です。ガイドラインでは「無症候性高尿酸血症への薬物治療の導入は血清尿酸値8.0mg/dL以上を一応の目安にするが、適応は慎重にすべきで、現時点で得られているエビデンスや薬物の副作用について情報を患者に示し納得のうえで開始することが望ましい」6)との記載にとどまっています。
- 6)日本痛風・尿酸核酸学会ガイドライン改訂委員会 高尿酸血症・痛風の治療ガイドライン 第3版 診断と治療社 2018 : 114-7
尿酸コントロールにおけるURAT1の重要性と
ドチヌラドの特徴
近位尿細管における尿酸再吸収は、血清尿酸値に影響を及ぼす重要な尿酸輸送機構です。そして、URAT1は、近位尿細管における尿酸再吸収に関与する主要なトランスポーターです7)。このことから、URAT1は高尿酸血症治療における重要なターゲットと考えられます。
- 7)Ichida K, et al. J Am Soc Nephrol 2004 ; 15 : 164-73
ドチヌラドの尿酸トランスポーター阻害能を検討したin vitro試験によると、ドチヌラドはABCG2、OAT1、OAT3に比べて、URAT1の選択性が高いことが示されています8,9)。
つまり、ドチヌラドは近位尿細管においてURAT1を介した尿酸再吸収経路を阻害する一方、ABCG2やOAT1、OAT3を介した尿酸分泌経路を阻害せずに尿酸降下作用を示すと考えられます。
- 8)社内資料 : ヒトABCG2、OAT1及びOAT3 発現細胞を用いた尿酸取り込み阻害試験(2020年1月23日承認、CTD 2.6.2.2)
- 9)Taniguchi T, et al. J Pharmacol Exp Ther 2019 ; 371 : 162-70
[利益相反]本文献の著者のうち8名は株式会社富士薬品、2名は持田製薬株式会社の社員である。
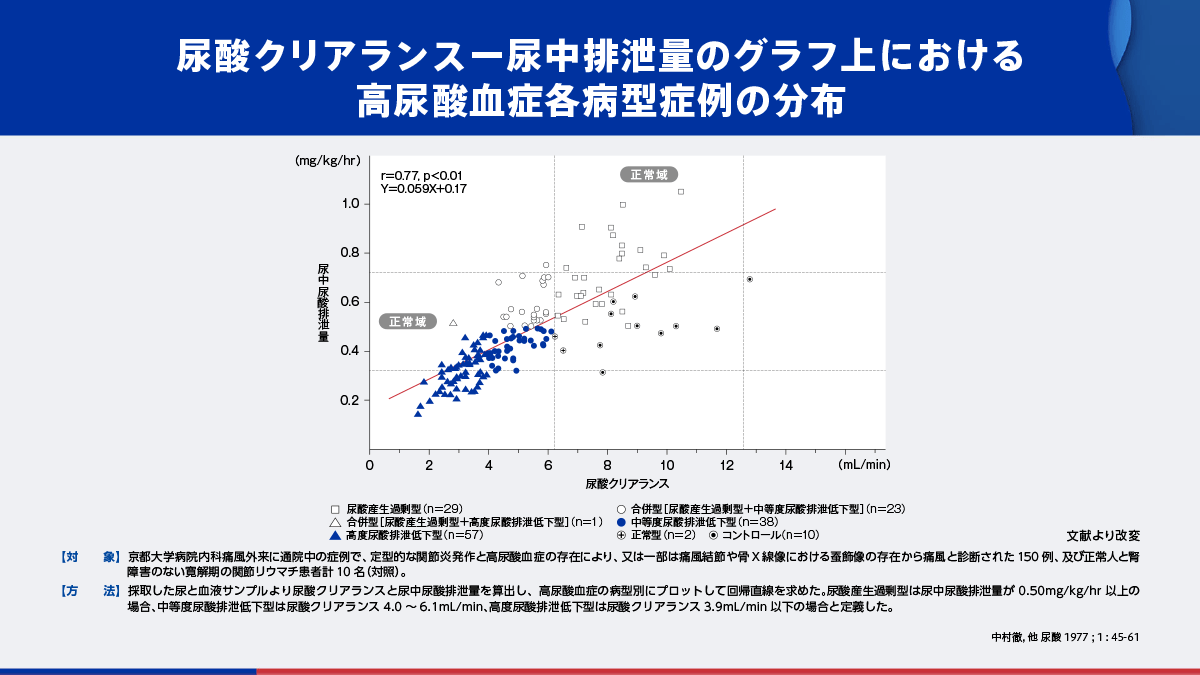
痛風患者を対象として尿酸クリアランスと尿中尿酸排泄量の関係を検討した研究のデータにおいて、病型別プロットを詳細に検討すると、尿酸排泄低下型の多くは、回帰直線よりも下に位置しています10)。これらの患者は、尿中尿酸排泄量が推定値よりも減少していることを意味しており、主に腸管における腎外排泄が亢進した状態にあることが推測されます。
ドチヌラドのABCG2阻害作用はURAT1阻害作用に比べて弱く、亢進状態にある腎外排泄に影響を及ぼしにくいものと考えられます。
もしドチヌラドがABCG2による腎外排泄を抑制すると、抑制しない場合と同程度に血清尿酸値を低下させるには腎臓での尿酸排泄量を増やす必要があり、尿路の尿酸負荷が増加する懸念が高まることを意味します。
- 10)中村徹, 他 尿酸 1977 ; 1 : 45-61
ドチヌラドの臨床効果
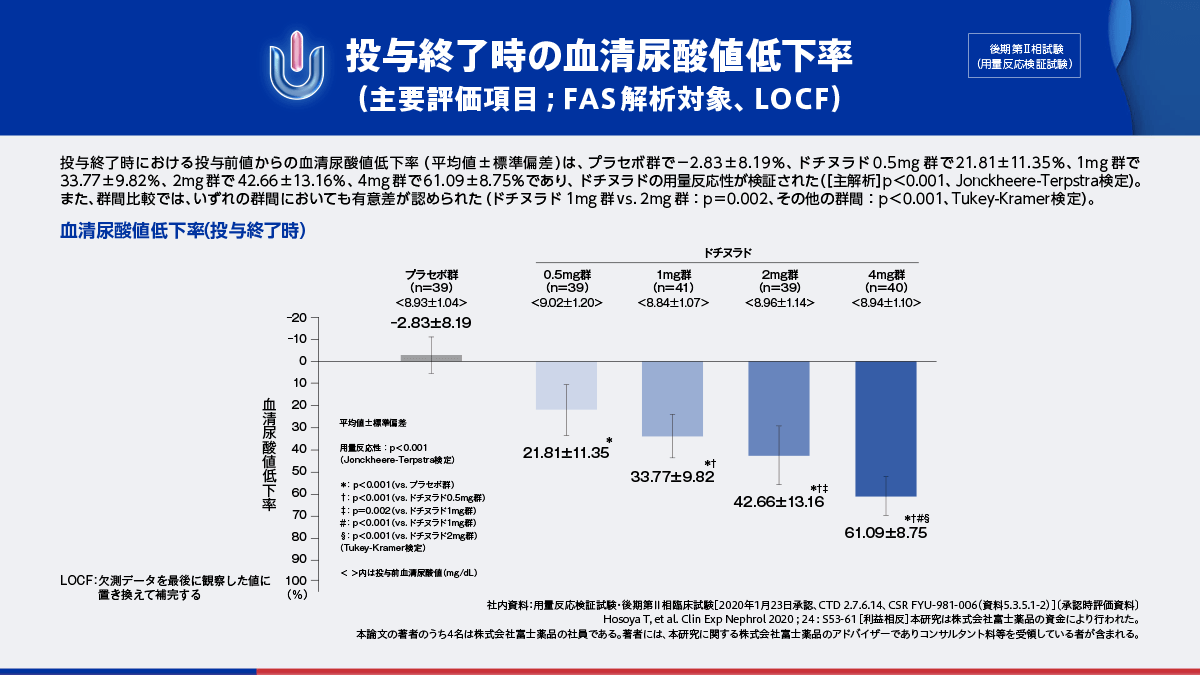
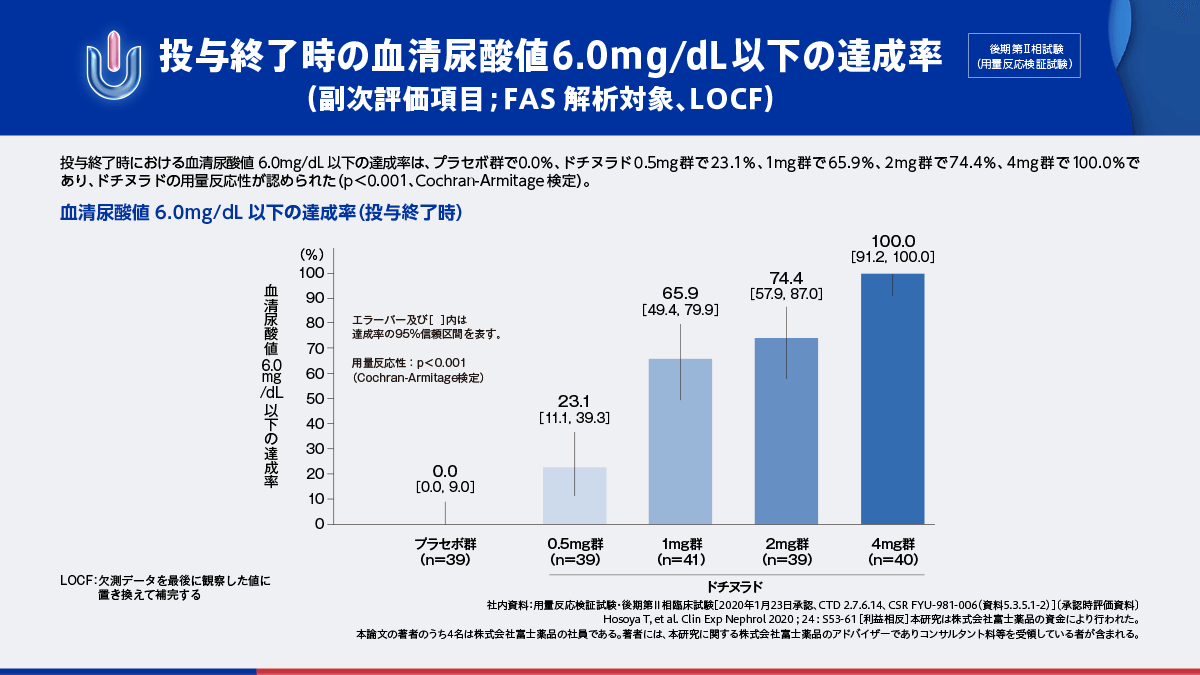
ドチヌラドの後期第Ⅱ相試験11,12)では、主要評価項目である投与終了時の血清尿酸値低下率は、ドチヌラド0.5mg群から4mg群において用量反応性が検証されました。また、副次評価項目の血清尿酸値6.0mg/dL以下の達成率は、プラセボ群で0.0%、ドチヌラド0.5mg群で23.1%、1mg群で65.9%、2mg群で74.4%、4mg群で100.0%であり、ドチヌラドの用量反応性が認められました。
一方、安全性について、痛風関節炎を除く副作用及び痛風関節炎の副作用は、プラセボ群で15.4%及び0.0%、ドチヌラド0.5mg群で12.5%及び2.5%、1mg群で14.3%及び4.8%、2mg群で15.4%及び7.7%、4mg群で10.0%及び7.5%に認められました。
- 11)社内資料 : 用量反応検証試験・後期第Ⅱ相臨床試験[2020年1月23日承認、CTD 2.7.6.14、CSR FYU-981-006(資料5.3.5.1-2)]〔承認時評価資料〕
- 12)Hosoya T, et al. Clin Exp Nephrol 2020 ; 24 : S53-61
[利益相反]本研究は株式会社富士薬品の資金により行われた。本論文の著者のうち4名は株式会社富士薬品の社員である。
著者には、本研究に関する株式会社富士薬品のアドバイザーでありコンサルタント料等を受領している者が含まれる。
COVID-19に関連した高尿酸血症・痛風患者への
アプローチのポイント
2021年3月現在、新型コロナウイルス感染症、COVID-19の感染拡大が世界的な問題となっています。
高尿酸血症や痛風の患者さんにおいては、COVID-19感染防止のために不要不急の外出を控えることで、運動不足やストレスに伴う飲酒量の増加を招くなど、適切な生活習慣を維持しづらい状況にあることが推測されます。
日本痛風・尿酸核酸学会では、患者さんへの注意喚起を目的とした情報をホームページで発信しています13)。
主な注意点は、「食生活の乱れや運動不足など、生活習慣が乱れないように気をつけること」、「服薬を継続すること」の2点です。
患者さんには、ホームページをご紹介いただくとともに、この2点について十分にお伝えいただき、注意喚起に努めていただけましたら幸いです。
- 13)日本痛風・尿酸核酸学会:“新型 コロナウイルス感染症(COVID-19)関連情報”
https://www.tukaku.jp/covid19/5386.html 2020/11/09 閲覧
おわりに
「かかりつけ医のための尿酸コントロールのポイント」として、管理目標値の考え方やSURI であるドチヌラドの特徴と臨床効果について紹介しました。
2020年に登場したドチヌラドは、今後ますます臨床経験が蓄積され、日常診療での使い方が明らかになってくると思います。是非、ドチヌラドを活用したよりよい高尿酸血症・痛風治療について、今後も先生方と一緒に考えていきたいと思います。
「禁忌を含む使用上の注意」等は添付文書をご参照ください。
後期第Ⅱ相試験(用量反応検証試験)
後期第Ⅱ相試験は一部承認外の成績が含まれますが、用量反応検証試験として実施されたため掲載します。
- 社内資料:用量反応検証試験・後期第Ⅱ相臨床試験[2020年1月23日承認、CTD 2.7.6.14、CSR FYU-981-006(資料5.3.5.1-2)]〔承認時評価資料〕
- Hosoya T, et al. Clin Exp Nephrol 2020 ; 24 : S53-61
- [利益相反] 本研究は株式会社富士薬品の資金により行われた。本論文の著者のうち4名は株式会社富士薬品の社員である。
- 著者には、本研究に関する株式会社富士薬品のアドバイザーでありコンサルタント料等を受領している者が含まれる。
投与終了時の血清尿酸値低下率(主要評価項目;FAS解析対象、LOCF)
ドチヌラド0.5mg群~4mg群において、用量反応性が検証されました。
投与終了時の血清尿酸値6.0mg/dL以下の達成率(副次評価項目;FAS解析対象、LOCF)
ドチヌラド0.5mg群~4mg群において、用量反応性が認められました。
安全性(SP解析対象)注)
痛風関節炎を除く副作用(臨床検査値異常を含む)及び痛風関節炎の副作用は、プラセボ群で15.4%及び0.0%、ドチヌラド0.5mg群で12.5%及び2.5%、1mg群で14.3%及び4.8%、2mg群で15.4%及び7.7%、4mg群で10.0%及び7.5%に認められました。
痛風関節炎を除く副作用(臨床検査値異常を含む)は、プラセボ群で6/39例(15.4%)、ドチヌラド0.5mg群で5/40 例(12.5%)、1mg群で6/42 例(14.3%)、2mg群で6/39例(15.4%)、4mg群で4/40例(10.0%)に認められました。
そのうち、2例以上に発現した副作用は、プラセボ群で尿中β2ミクログロブリン増加2/39例(5.1%)、ドチヌラド1mg群でβ‒NアセチルDグルコサミニダーゼ増加3/42例(7.1%)、2mg群で尿中β2ミクログロブリン増加、β‒NアセチルDグルコサミニダーゼ増加、白血球数増加各2/39例(5.1%)、4mg群で尿中β2ミクログロブリン増加、β‒NアセチルDグルコサミニダーゼ増加、α1ミクログロブリン増加各2/40例(5.0%)でした。
ドチヌラド0.5mg群では、四肢不快感、γ‒グルタミルトランスフェラーゼ増加等が各1/40例(2.5%)に認められました。
死亡例を含む重篤な副作用は認められず、投与中止に至った痛風関節炎を除く副作用は、プラセボ群で尿中β2ミクログロブリン増加が1例に認められました。
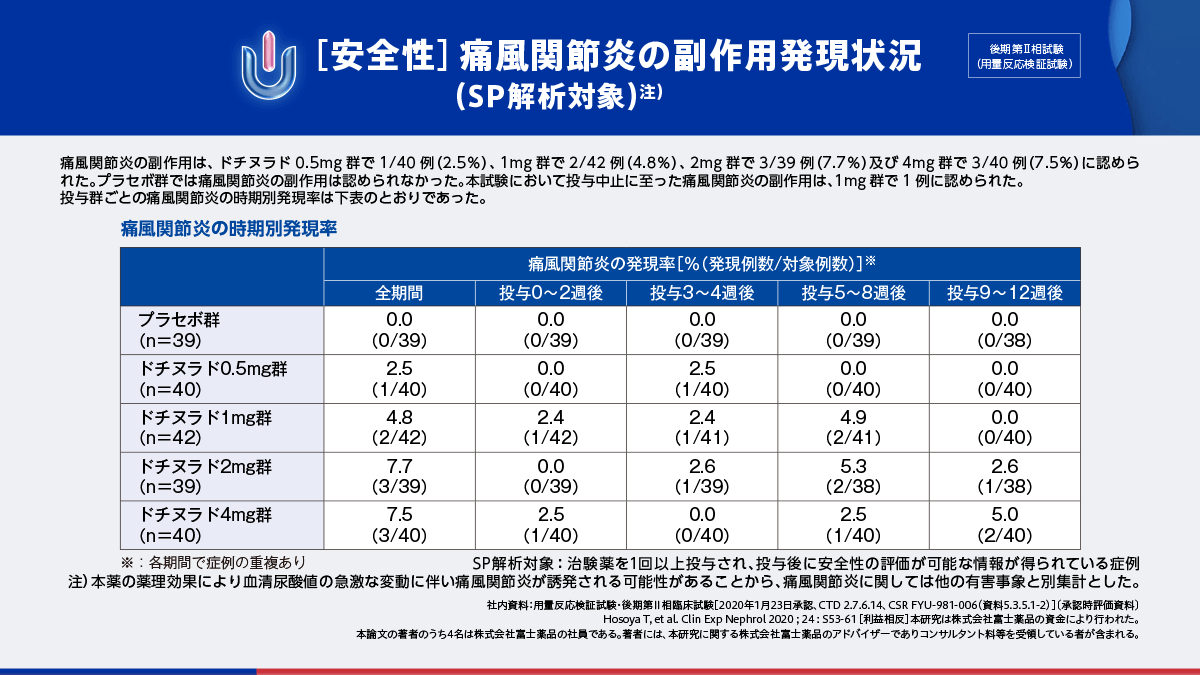
一方、痛風関節炎の副作用は、ドチヌラド0.5mg群で1/40例(2.5%)、1mg群で2/42例(4.8%)、2mg群で3/39例(7.7%)及び4mg群で3/40例(7.5%)に認められ、プラセボ群では認められませんでした。
投与中止に至った痛風関節炎の副作用は、ドチヌラド 1mg群で1例に認められました。
投与群ごとの痛風関節炎の時期別発現率は右下表のとおりでした。
- 注)本薬の薬理効果により血清尿酸値の急激な変動に伴い痛風関節炎が誘発される可能性があることから、痛風関節炎に関しては他の有害事象と別集計とした。
【用法及び用量】
通常、成人にはドチヌラドとして1日0.5mgより開始し、1日1回経口投与する。その後は血中尿酸値を確認しながら必要に応じて徐々に増量する。維持量は通常1日1回2mgで、患者の状態に応じて適宜増減するが、最大投与量は1日1回4mgとする。
コンテンツ評価にご協力をお願いいたします。
このコンテンツは参考になりましたでしょうか?
ご回答ありがとうございます。
マイページ設定により、先生のご興味のある領域/製品の最新情報を
効率的にチェックすることができます!
今後のコンテンツ改善のために、
「参考にならなかった」理由を
教えてください。
(複数回答可)

引き続き、持田製薬 医療関係者向けサイトを
よろしくお願いいたします。