- 医療関係者向けホーム
- 循環器領域
- ユリス®錠
- Clinical Study:第Ⅲ相試験(長期投与試験) 試験の概要
 Clinical Study第Ⅲ相試験(長期投与試験)
Clinical Study第Ⅲ相試験(長期投与試験)
試験の概要「第Ⅲ相試験(長期投与試験)」
- 社内資料:第Ⅲ相長期投与試験[2020年1月23日承認、CTD 2.7.6.17、CSR FYU-981-010(資料5.3.5.2-1)]〔承認時評価資料〕
- 社内資料:長期投与試験における臨床最大用量の検討(2020年1月23日承認、CTD 2.7.3.4.2.2)〔承認時評価資料〕
- Hosoya T, et al. Clin Exp Nephrol 2020 ; 24 : S80-91
[利益相反]本研究は株式会社富士薬品の資金により行われた。本論文の著者のうち4名は株式会社富士薬品の社員である。
著者には、本研究に関する株式会社富士薬品のアドバイザーでありコンサルタント料等を受領している者が含まれる。
- 「禁忌を含む注意事項等情報」等は電子添文をご参照ください。
試験デザイン
多施設共同、非盲検、用量漸増試験
目的
痛風を含む高尿酸血症患者を対象として、ドチヌラドの長期投与における有効性及び安全性の検討を行う。
対象
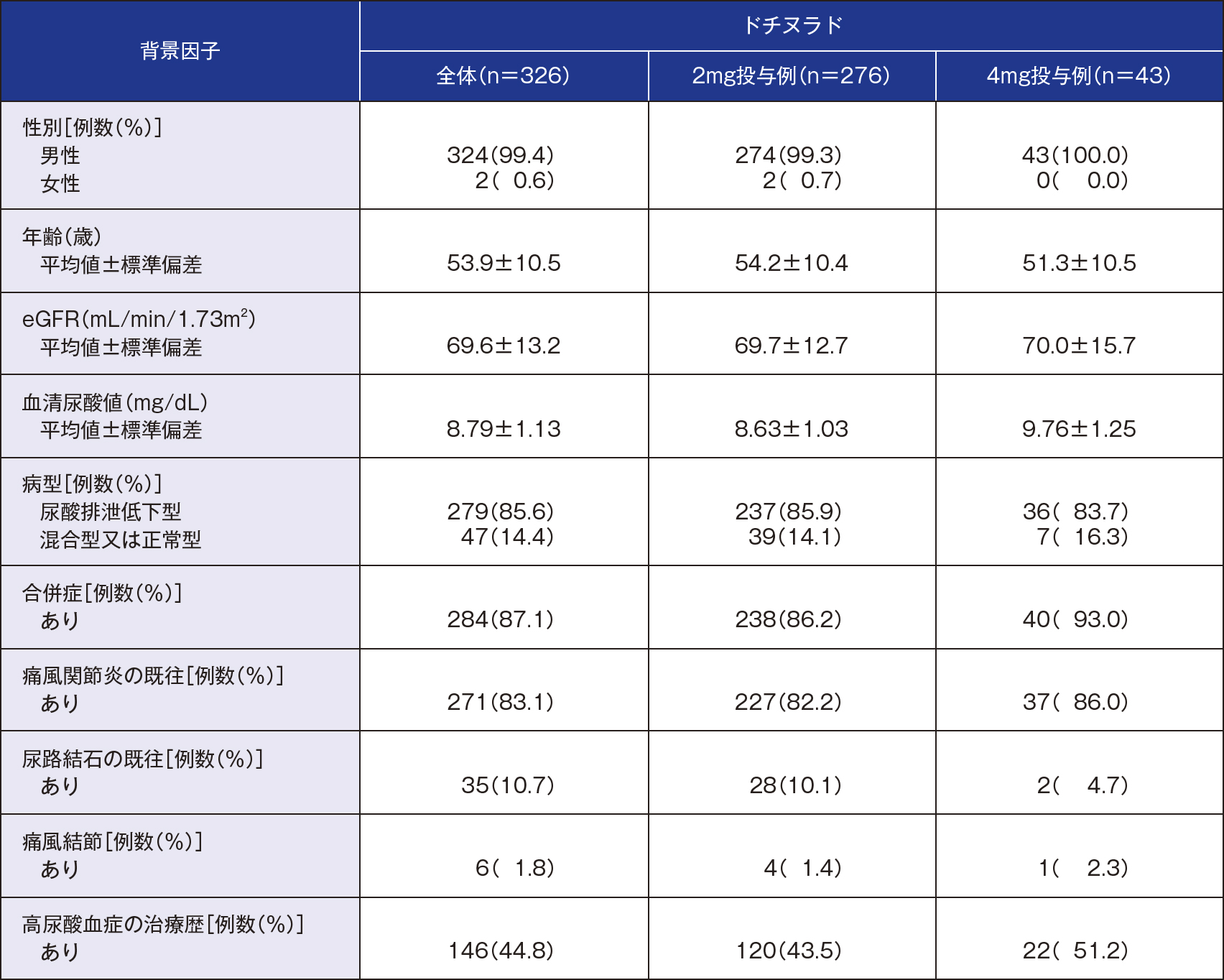
20歳以上の痛風を含む高尿酸血症患者※1(割付症例数:330、投与症例数:330)
[血清尿酸値:痛風患者7.0mg/dL以上、高尿酸血症患者(合併症※2あり)8.0mg/dL以上、高尿酸血症患者(合併症※2なし)9.0mg/dL以上]
- ※1「尿酸産生過剰型」あるいは「判定不能」を除く
※2 高血圧、糖尿病、メタボリックシンドローム
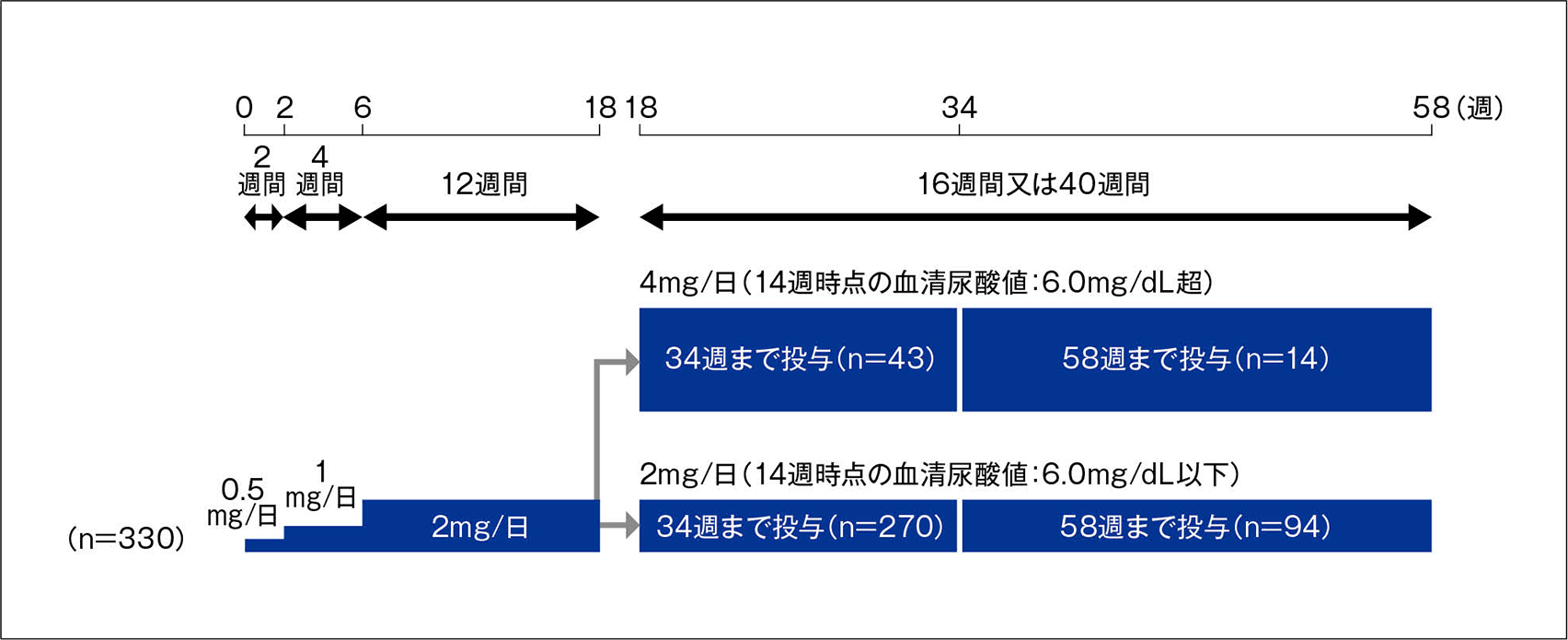
投与方法
対象患者にドチヌラドを1日1回朝食後に経口投与した。ドチヌラドは0.5mg/日を投与開始から2週後まで2週間投与した後、1mg/日に増量して3週目から6週後まで4週間投与し、さらに2mg/日に増量して7週目から18週後まで12週間投与した。投与14週後の血清尿酸値が6.0mg/dL以下の場合は、ドチヌラド投与量を2mg/日に維持して19週目から34週後又は58週後まで16週間又は40週間投与した(ドチヌラド2mg投与例)。投与14週後の血清尿酸値が6.0mg/dLを超えていた場合は、ドチヌラド投与量を4mg/日に増量して19週目から34週後又は58週後まで16週間又は40週間投与した(ドチヌラド4mg投与例)。
評価項目
有効性に関する評価項目
【主要評価項目】
各時点(投与2週後以降、58週後まで4週ごと)及び投与終了時における投与前値からの血清尿酸値低下率
[(投与前値-投与後値)/投与前値×100]
【副次評価項目】
- 各時点(投与2週後以降、58週後まで4週ごと)及び投与終了時における血清尿酸値
- 各時点(投与2週後以降、58週後まで4週ごと)及び投与終了時における血清尿酸値6.0mg/dL以下の達成率
[血清尿酸値が6.0mg/dL以下の例数/有効性評価対象例数×100]
<ドチヌラド4mg投与例での検討>
- 各時点(投与22週後以降、58週後まで4週ごと)及び投与終了時における投与18週後からの血清尿酸値低下率
- 投与18週後と投与終了時における血清尿酸値、血清尿酸値低下率、血清尿酸値6.0mg/dL以下の達成率
など
安全性に関する評価項目
- 有害事象
- 副作用
- 痛風関節炎
など
解析計画
主要評価項目について、ドチヌラド全体、2mg投与例、4mg投与例ごとの血清尿酸値低下率(各時点及び投与終了時)の要約統計量を算出し、投与前値との比較を行った。
副次評価項目について、各時点及び投与終了時における血清尿酸値、投与18週からの血清尿酸値低下率、血清尿酸値6.0mg/dL以下の達成率の要約統計量を算出した。
6. 用法及び用量
通常、成人にはドチヌラドとして1日0.5mgより開始し、1日1回経口投与する。その後は血中尿酸値を確認しながら必要に応じて徐々に増量する。維持量は通常1日1回2mgで、患者の状態に応じて適宜増減するが、最大投与量は1日1回4mgとする。