- 医療関係者向けホーム
- 循環器領域
- ユリス®錠
- Clinical Study:第Ⅲ相試験(フェブキソスタット対照非劣性試験) 試験の概要
 Clinical Study第Ⅲ相試験(フェブキソスタット対照非劣性試験)
Clinical Study第Ⅲ相試験(フェブキソスタット対照非劣性試験)
試験の概要「第Ⅲ相試験(フェブキソスタット対照非劣性試験)」
- 社内資料:第Ⅲ相フェブキソスタット対照試験[2020年1月23日承認、CTD 2.7.6.16、CSR FYU-981-014(資料5.3.5.1-4)]〔承認時評価資料〕
- Hosoya T, et al. Clin Exp Nephrol 2020 ; 24 : S71-9
[利益相反]本研究は持田製薬株式会社及び株式会社富士薬品の資金により行われた。本論文の著者のうち2名は持田製薬株式会社の
社員である。著者には、本研究に関する株式会社富士薬品のアドバイザーでありコンサルタント料等を受領している者が含まれる。
- 「禁忌を含む注意事項等情報」等は電子添文をご参照ください。
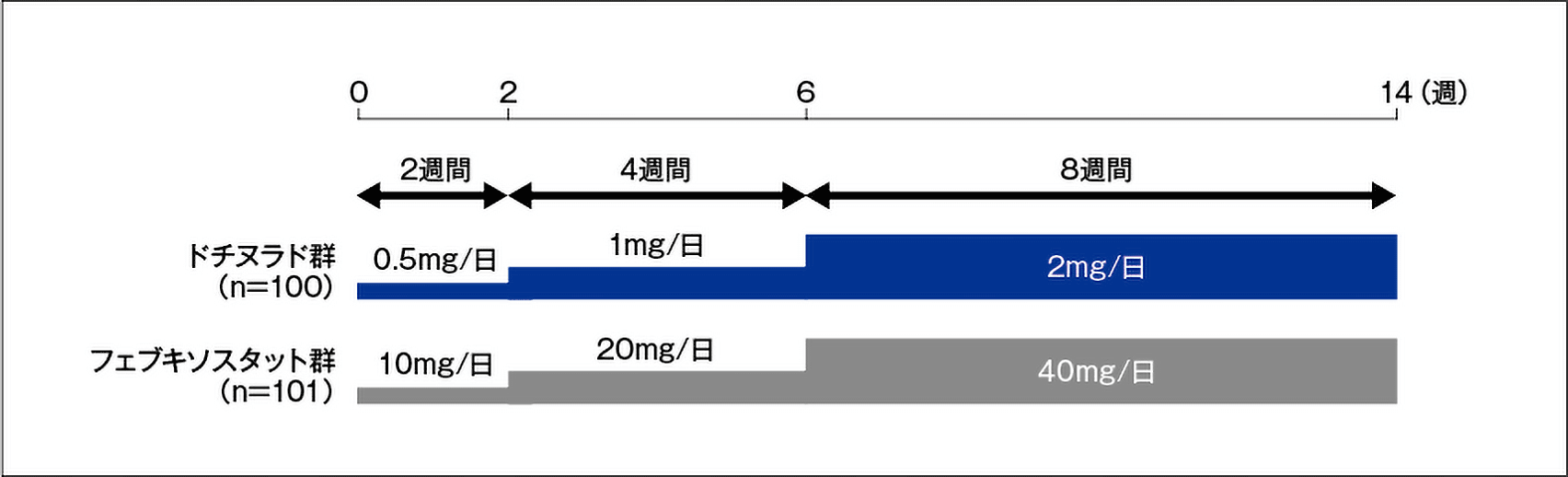
試験デザイン
多施設共同、二重盲検、ランダム化、実薬対照、用量漸増並行群間比較試験
目的
痛風を含む高尿酸血症患者を対象として、ドチヌラドのフェブキソスタットに対する非劣性の検証及び安全性の検討を行う。
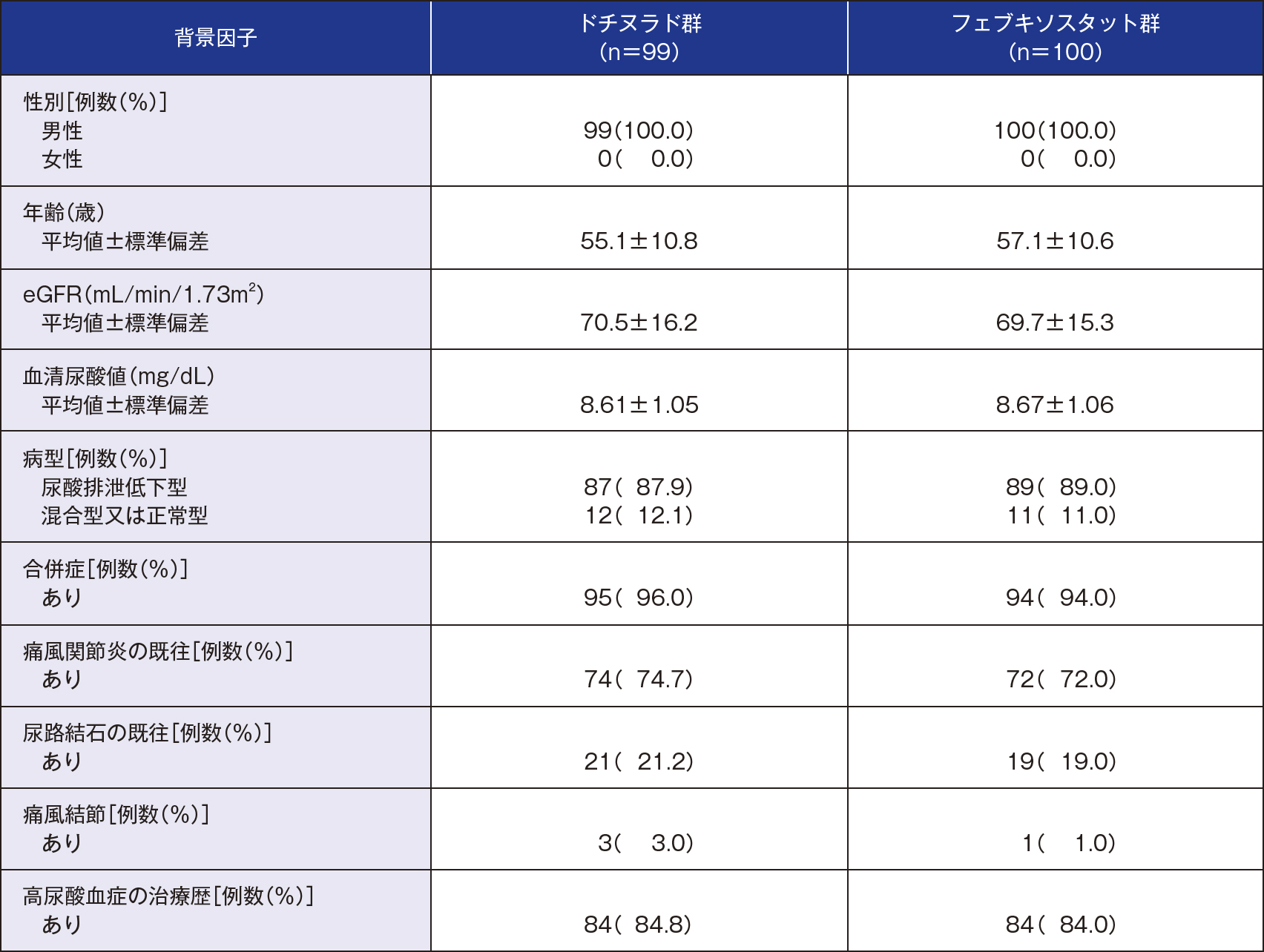
対象
20歳以上の痛風を含む高尿酸血症患者※1(割付症例数:203、投与症例数:201)
[血清尿酸値:痛風患者7.0mg/dL以上、高尿酸血症患者(合併症※2あり)8.0mg/dL以上、高尿酸血症患者(合併症※2なし)9.0mg/dL以上]
- ※1「尿酸排泄低下型」、「混合型」又は「正常型」
※2 高血圧、糖尿病、メタボリックシンドローム
投与方法
対象患者をドチヌラド群又はフェブキソスタット群の2群にランダムに割り付け、治験薬を1日1回朝食後に経口投与した。ドチヌラド群は0.5mg/日を投与開始から2週後まで2週間投与した後、1mg/日に増量して3週目から6週後まで4週間投与し、さらに2mg/日に増量して7週目から14週後まで8週間投与した。フェブキソスタット群は10mg/日を投与開始から2週後まで2週間投与した後、20mg/日に増量して3週目から6週後まで4週間投与し、さらに40mg/日に増量して7週目から14週後まで8週間投与した。
評価項目
有効性に関する評価項目
【主要評価項目】
投与終了時(投与14週後又は投与中止時)における投与前値からの血清尿酸値低下率
[(投与前値-投与終了時の値)/投与前値×100](検証的解析項目)
【副次評価項目】
- 各時点(投与2、6、10、14週後)における投与前値からの血清尿酸値低下率
- 各時点(投与前、投与2、6、10、14週後)及び投与終了時における血清尿酸値
- 各時点(投与2、6、10、14週後)及び投与終了時における血清尿酸値6.0mg/dL以下の達成率[血清尿酸値が6.0mg/dL以下の例数/有効性評価対象例数×100]
など
安全性に関する評価項目
- 有害事象
- 副作用
- 痛風関節炎
など
解析計画
主要評価項目について、平均値の差の両側95%信頼区間の下限値が非劣性マージン(-10%)を上回った場合を非劣性とした。なお、非劣性マージンを考慮した2標本t検定を用いて非劣性検定を行った。
副次評価項目について、投与群ごとに血清尿酸値低下率(各時点)、血清尿酸値(各時点及び投与終了時)、血清尿酸値6.0mg/dL以下の達成率(各時点及び投与終了時)の要約統計量を算出した。
6. 用法及び用量
通常、成人にはドチヌラドとして1日0.5mgより開始し、1日1回経口投与する。その後は血中尿酸値を確認しながら必要に応じて徐々に増量する。維持量は通常1日1回2mgで、患者の状態に応じて適宜増減するが、最大投与量は1日1回4mgとする。