- 医療関係者向けホーム
- 循環器領域
- ユリス®錠
- Clinical Study:肝機能障害者での臨床薬物動態試験(第Ⅰ相試験;肝機能障害者、単回投与) 試験の概要・血清尿酸値
 Clinical Study肝機能障害者での臨床薬物動態試験(第Ⅰ相試験;肝機能障害者、単回投与)
Clinical Study肝機能障害者での臨床薬物動態試験(第Ⅰ相試験;肝機能障害者、単回投与)
試験の概要「肝機能障害者での臨床薬物動態試験(第Ⅰ相試験;肝機能障害者、単回投与)」
- 社内資料:肝機能障害者における臨床薬理試験(2020年1月23日承認、CTD 2.7.6.7)〔承認時評価資料〕
- Kumagai Y, et al. Clin Exp Nephrol 2020; 24: S25-35
[利益相反]本研究は持田製薬株式会社及び株式会社富士薬品の資金により行われた。
本論文の著者のうち3名は持田製薬株式会社の社員である。
- 「禁忌を含む注意事項等情報」等は電子添文をご参照ください。
試験方法
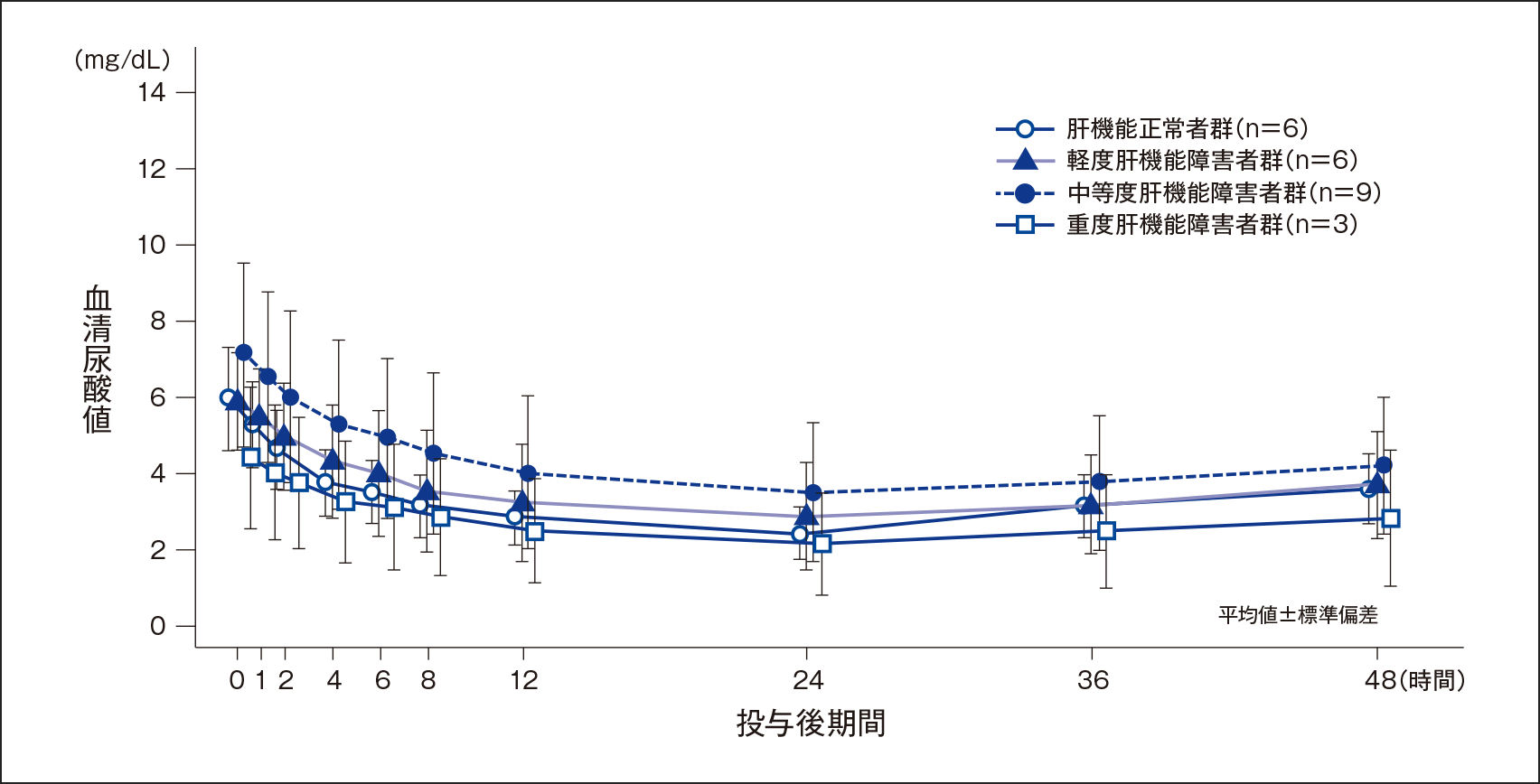
肝機能正常者(6例)又は軽度(6例)、中等度(9例)、重度(3例)の肝機能障害者に、ドチヌラド4mgを絶食下で単回経口投与し、投与48時間後までの血清尿酸値を測定した。
血清尿酸値
血清尿酸値の推移
投与前の血清尿酸値(平均値±標準偏差)は、肝機能正常者群で5.95±1.34mg/dL、軽度肝機能障害者群で5.90±1.26mg/dL、中等度肝機能障害者群で7.12±2.39mg/dL、重度肝機能障害者群で4.43±1.86mg/dLであった。投与24時間後では、それぞれ2.43±0.69mg/dL、2.88±1.41mg/dL、3.52±1.80mg/dL、2.17±1.33mg/dLであり、投与48時間後では、それぞれ3.60±0.91mg/dL、3.73±1.39mg/dL、4.22±1.78mg/dL、2.83±1.80mg/dLであった。
軽度肝機能障害者:Child-Pugh分類A(Child-Pughスコア5~6)、
中等度肝機能障害者:Child-Pugh分類B(Child-Pughスコア7~9)、
重度肝機能障害者:Child-Pugh分類C(Child-Pughスコア10~15)
6. 用法及び用量
通常、成人にはドチヌラドとして1日0.5mgより開始し、1日1回経口投与する。その後は血中尿酸値を確認しながら必要に応じて徐々に増量する。維持量は通常1日1回2mgで、患者の状態に応じて適宜増減するが、最大投与量は1日1回4mgとする。
8. 重要な基本的注意(一部抜粋)
- 8.3 他の尿酸排泄促進薬において重篤な肝障害が報告されていることから、本剤投与中は、定期的に肝機能検査を行うなど、患者の状態を十分に観察すること。[9.3参照]
9. 特定の背景を有する患者に関する注意(一部抜粋)
9.3 肝機能障害患者
慎重な経過観察を行うこと。他の尿酸排泄促進薬では重篤な肝障害が認められている。
なお、臨床試験では、重篤な肝疾患を有する患者、AST又はALT 100IU/L以上の患者は除外されている。[8.3参照]