- 医療関係者向けホーム
- 循環器領域
- ユリス®錠
- Pick Up
- ひと目でわかるユリス®錠の患者背景別血清尿酸値低下作用
 Pick Up
Pick Up
「禁忌を含む使用上の注意」等は添付文書をご参照下さい。
第Ⅱ相及び第Ⅲ相二重盲検試験の
併合解析による
患者背景別血清尿酸値低下作用
(部分集団解析)
併合解析には一部承認外の成績が含まれますが、承認時に評価された資料であるため掲載します。
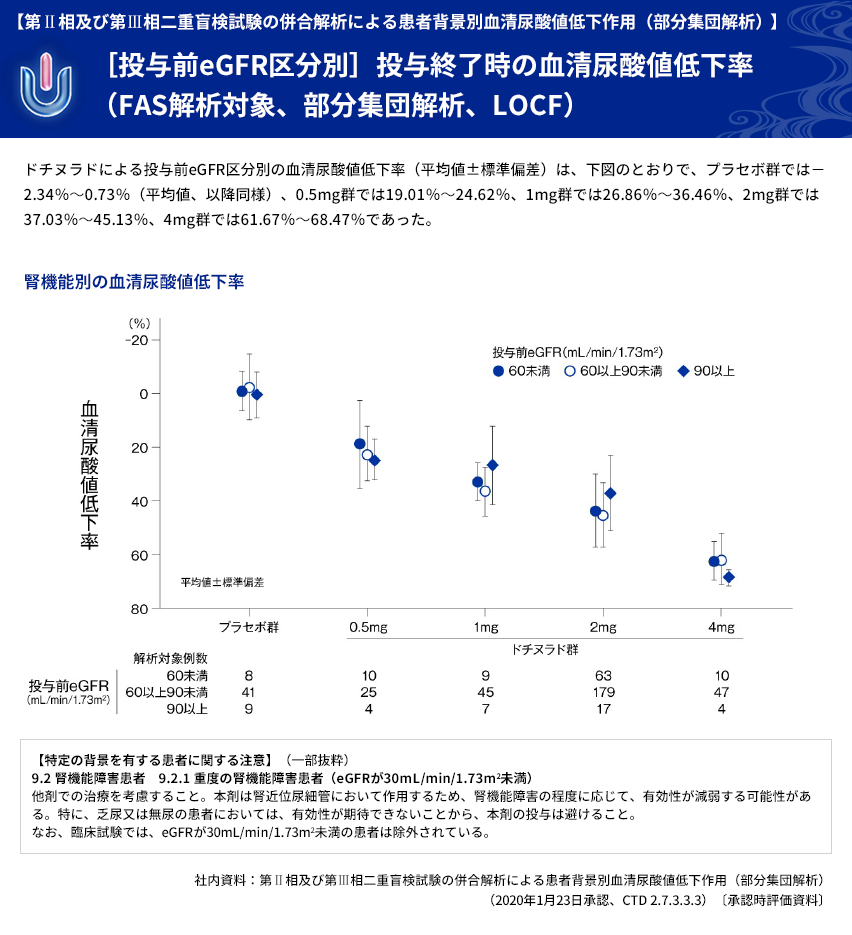
ユリス®錠は第Ⅱ相及び第Ⅲ相二重盲検試験の併合解析において、様々な項目について、患者背景別の血清尿酸値低下作用が検討されています。特定の背景を有する患者様にユリス®錠の処方を検討される際は、ぜひ下記のデータをご参考として下さい。
- 社内資料:第Ⅱ相及び第Ⅲ相二重盲検試験の併合解析による患者背景別血清尿酸値低下作用
- (部分集団解析)(2020年1月23日承認、CTD 2.7.3.3.3)〔承認時評価資料〕
- 社内資料:臨床試験(二重盲検試験の併合)の有害事象の解析(2020年1月23日承認、CTD 2.7.4.2.1)〔承認時評価資料〕
各項目をクリックするとデータが表示されます。
| 【目的】 | 承認時までに実施した、痛風を含む高尿酸血症患者を対象とした4つの二重盲検試験注) (プラセボ対照2試験、ベンズブロマロン対照1試験、フェブキソスタット対照1試験)を併合解析し、ドチヌラドの患者背景別の血清尿酸値低下作用の検討を行う。 |
|---|---|
| 【試験デザイン】 | 4つのランダム化、二重盲検、並行群間、用量漸増、群間比較試験注)の併合解析 |
| 【対象】 | 20歳以上の痛風を含む高尿酸血症患者 |
| 【投与方法】 | ドチヌラドを1日1回朝食後に経口投与した。 0.5mg群はドチヌラド0.25mg/日を投与開始から2週後まで2週間投与した後、 0.5mg/日に増量して3週目から12週後まで10週間投与した。 1mg群はドチヌラド0.25mg/日を投与開始から2週後まで2週間投与した後、 0.5mg/日に増量して3週目から4週後まで2週間投与し、さらに1mg/日に増量して 5週目から8週後又は12週後まで4週間又は8週間投与した。 2mg群はドチヌラド0.25mg/日を投与開始から2週後まで2週間投与した後、 0.5mg/日に増量して3週目から4週後まで2週間投与し、さらに2mg/日に増量して 5週目から8週後又は12週後まで4週間又は8週間投与するか、もしくは0.5mg/日を 投与開始から2週後まで2週間投与した後、1mg/日に増量して3週目から6週後まで 4週間投与し、さらに2mg/日に増量して7週目から14週後まで8週間投与した。 4mg群はドチヌラド0.25mg/日を投与開始から2週後まで2週間投与した後、 0.5mg/日に増量して3週目から4週後まで2週間投与し、さらに4mg/日に増量して 5週目から8週後又は12週後まで4週間又は8週間投与した。 プラセボ群はプラセボを投与開始から8週後又は12週後まで投与した。 |
| 【評価項目】 |
|
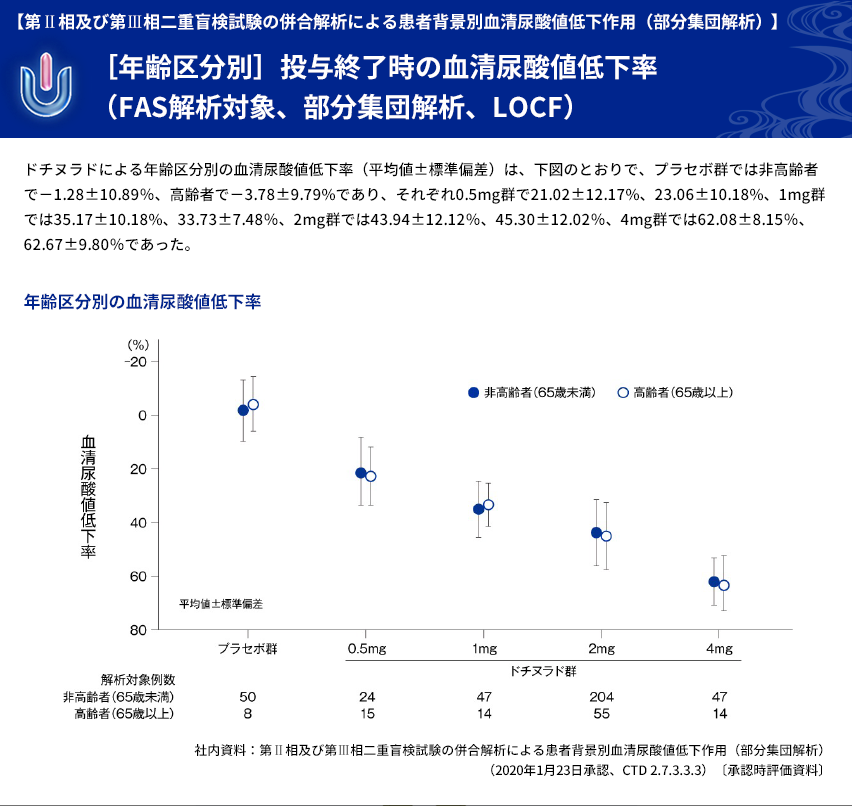
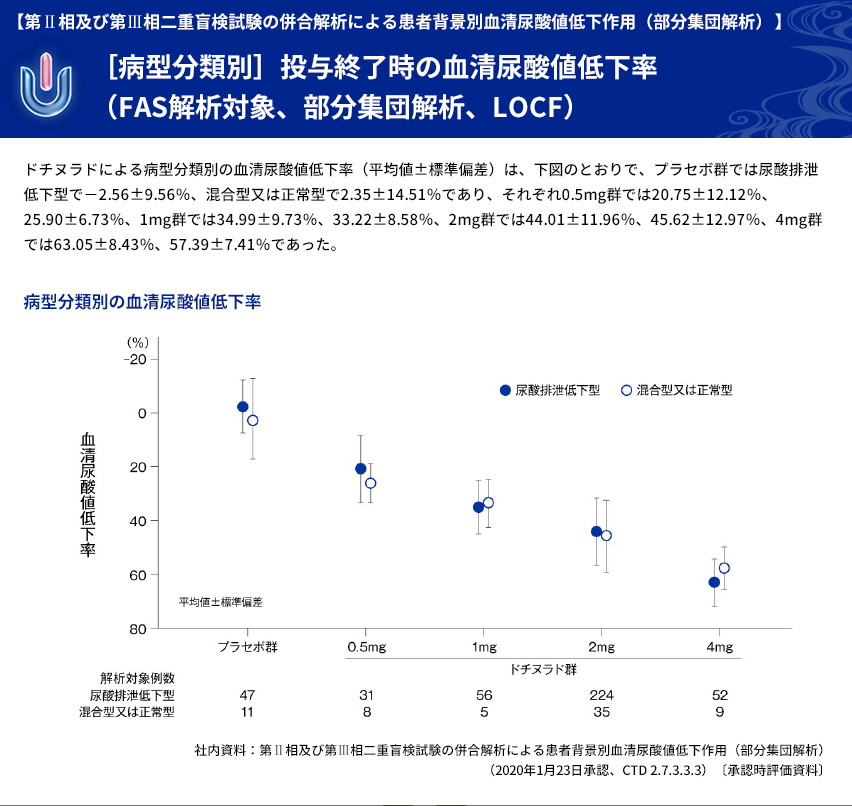
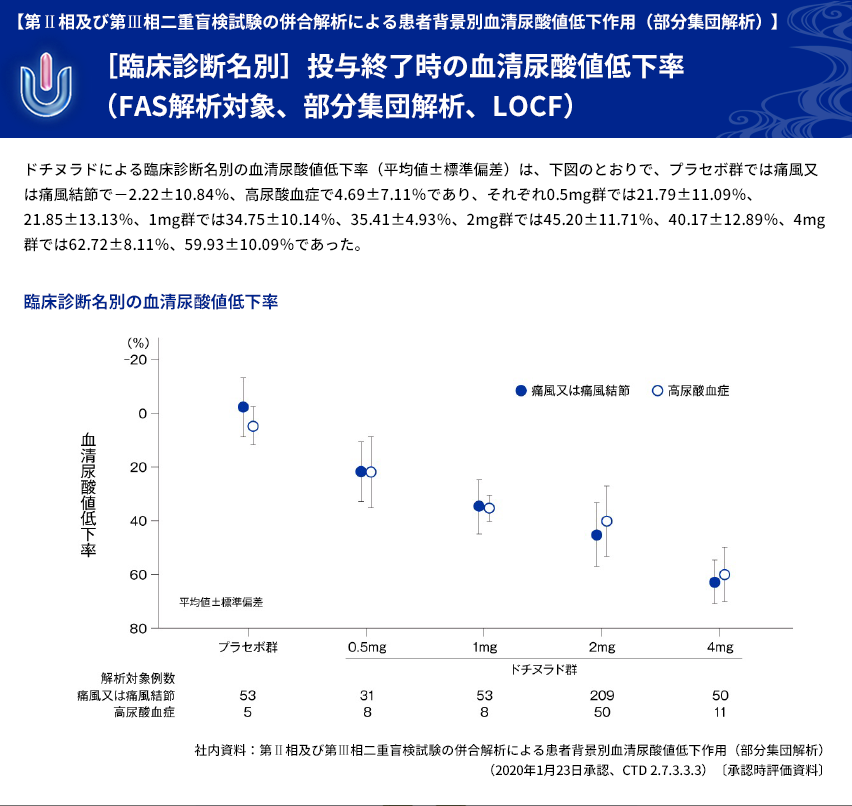
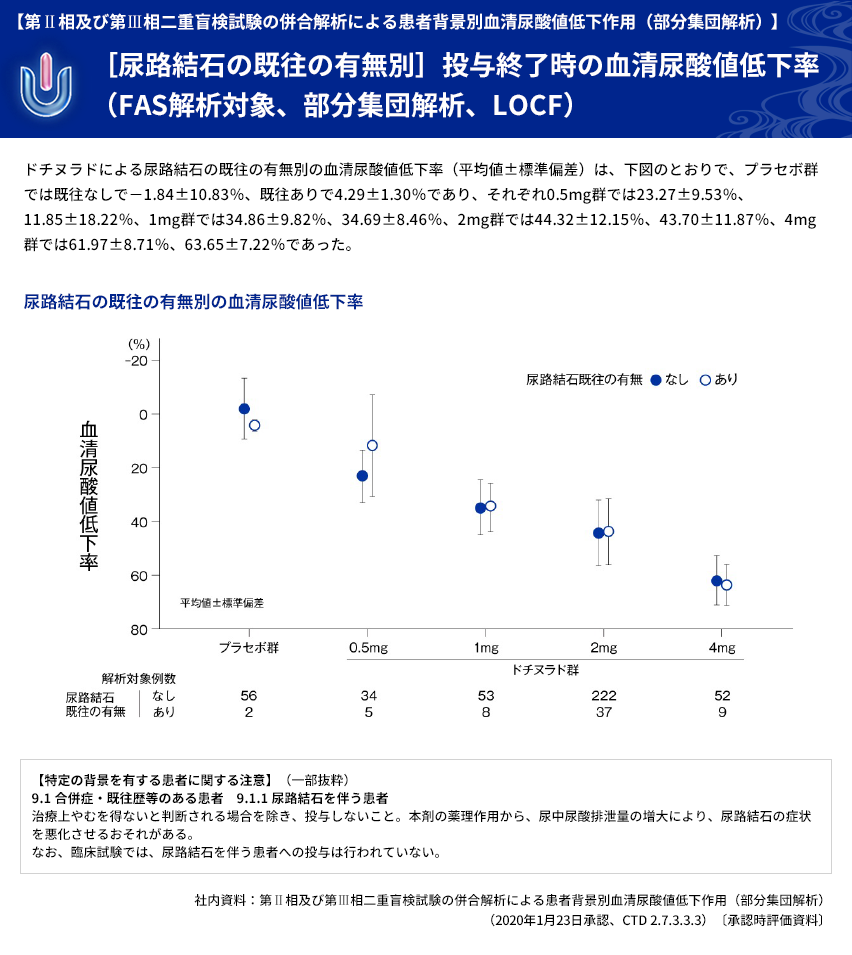
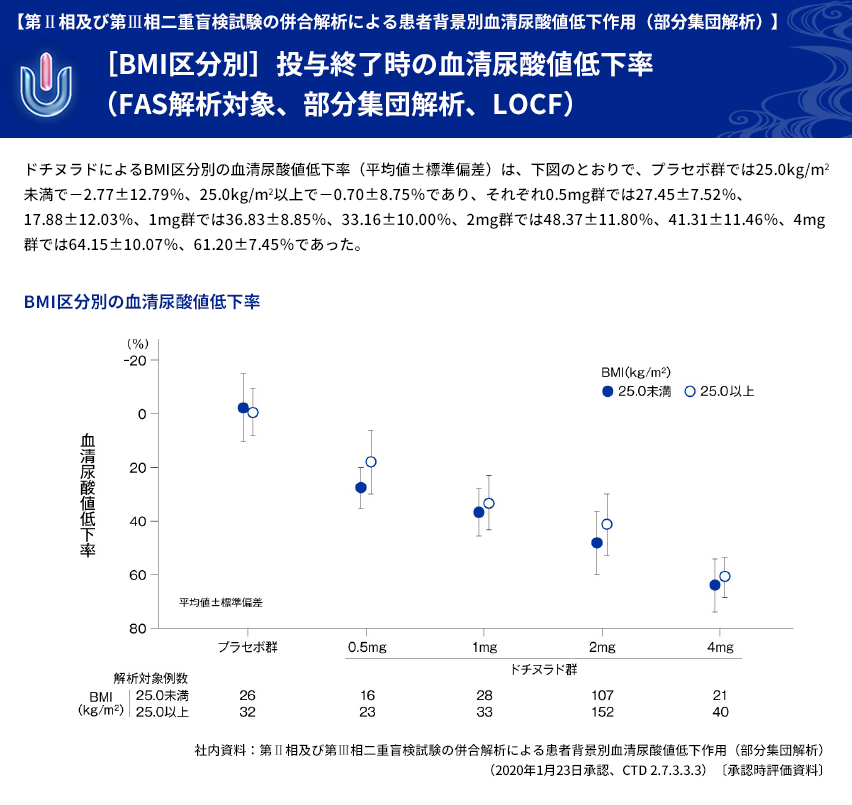
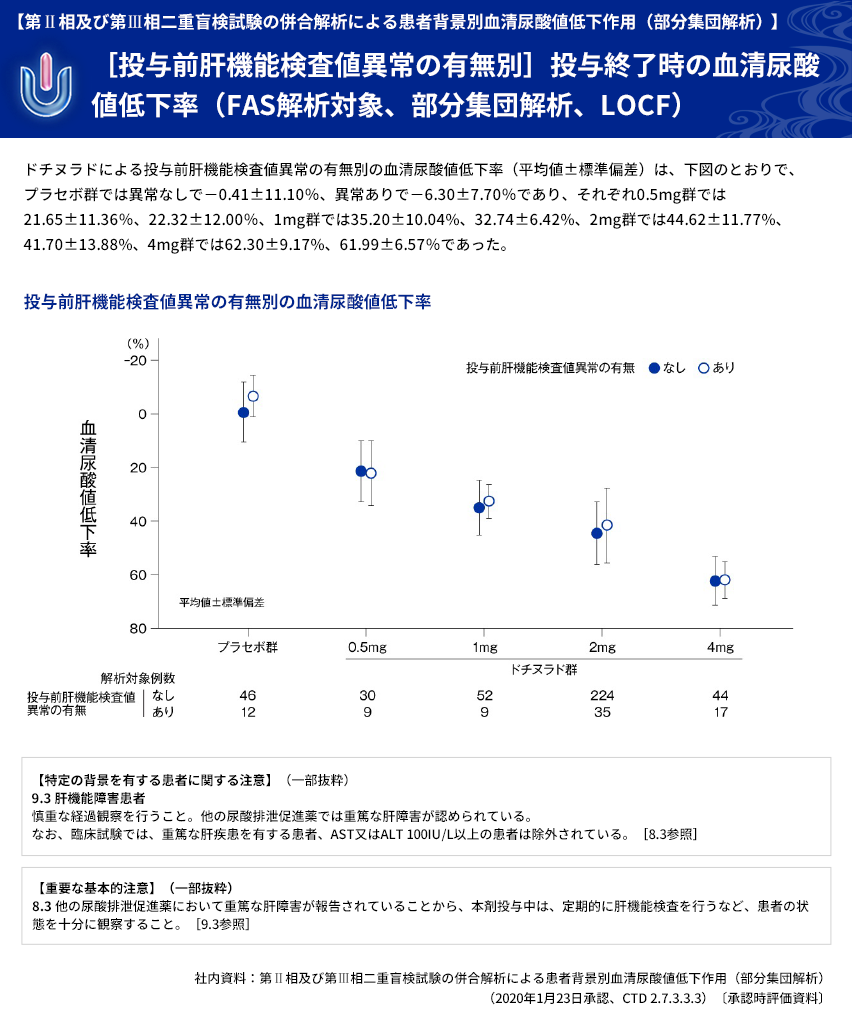
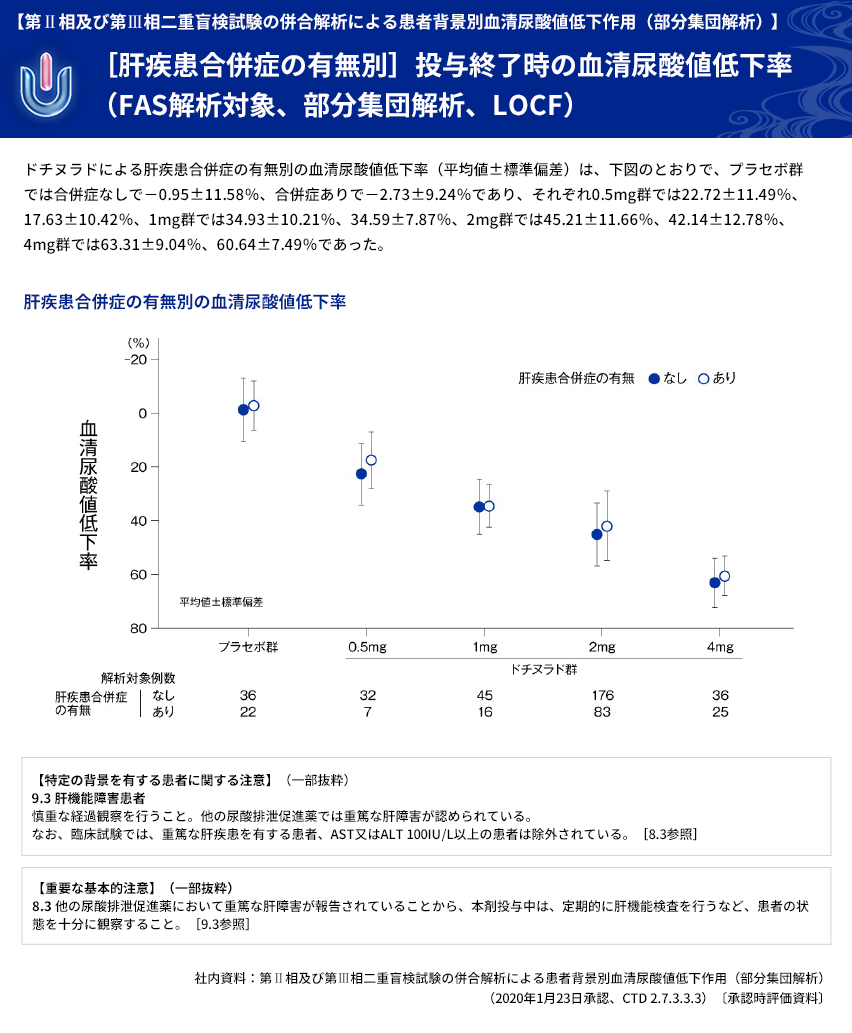
| 【解析計画】 | 投与群ごとの血清尿酸値低下率について、年齢区分別(65歳以上、65歳未満)、病型分類別、 臨床診断名別、尿路結石の既往の有無別、BMI区分別、投与前肝機能検査値異常の有無別、 肝疾患合併症の有無別、投与前eGFR区分別などに部分集団解析を行った。 |
- 注) 併合解析に含まれた4試験について、個々の試験結果は本コンテンツ中では紹介していません。
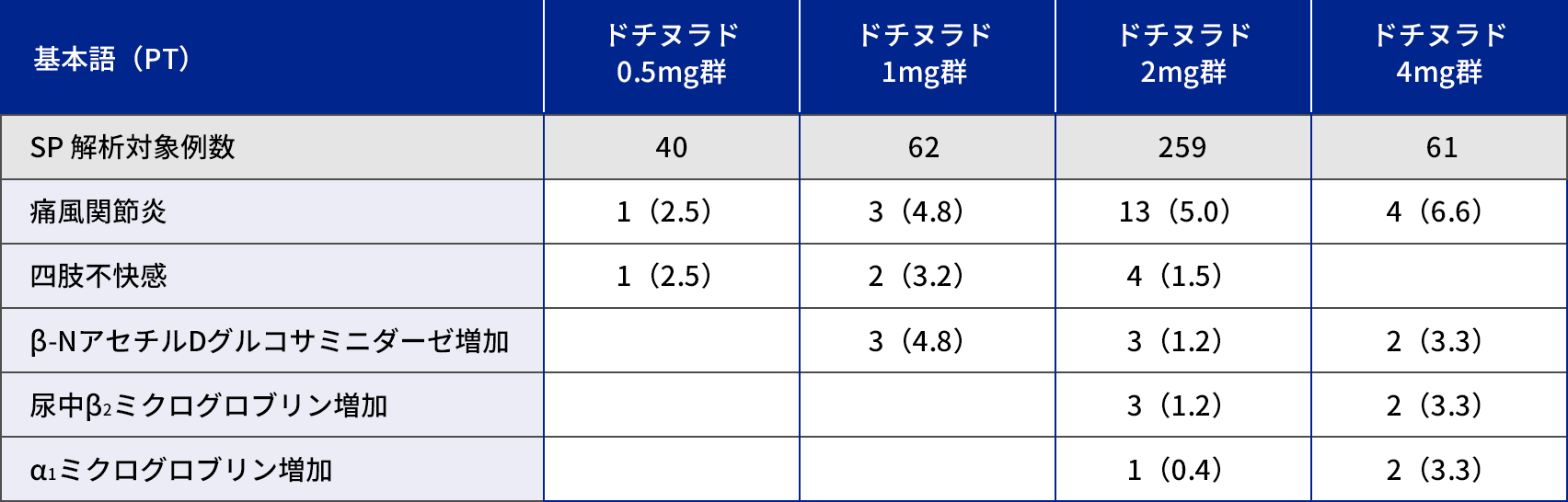
本剤投与群(0.5mg群、1mg群、2mg群、4mg群)において副作用は、70/422例(16.6%)に認められた。
本試験の本剤投与群において死亡例及び重篤な副作用は認められなかった。本試験の本剤投与群において中止に至った副作用は、1mg群に痛風関節炎が1例、2mg群に腹部不快感、滑液包炎、痛風関節炎がそれぞれ1例に認められた。
いずれかの投与群において発現率2%以上かつ発現例数2例以上に認められた副作用発現率
| 基本語(PT) | ドチヌラド 0.5mg群 |
ドチヌラド 1mg群 |
ドチヌラド 2mg群 |
ドチヌラド 4mg群 |
|---|---|---|---|---|
| SP 解析対象例数 | 40 | 62 | 259 | 61 |
| 痛風関節炎 | 1(2.5) | 3(4.8) | 13(5.0) | 4(6.6) |
| 四肢不快感 | 1(2.5) | 2(3.2) | 4(1.5) | |
| β-NアセチルDグルコサミニダーゼ増加 | 3(4.8) | 3(1.2) | 2(3.3) | |
| 尿中β2ミクログロブリン増加 | 3(1.2) | 2(3.3) | ||
| α1ミクログロブリン増加 | 1(0.4) | 2(3.3) |
コンテンツ評価にご協力をお願いいたします。
このコンテンツは参考になりましたでしょうか?
ご回答ありがとうございます。
マイページ設定により、先生のご興味のある領域/製品の最新情報を
効率的にチェックすることができます!
今後のコンテンツ改善のために、
「参考にならなかった」理由を
教えてください。
(複数回答可)

引き続き、持田製薬 医療関係者向けサイトを
よろしくお願いいたします。





![[安全性]本剤投与群における副作用発現状況](/newtemp/domain/img/newmajor/urece/evidence/pic_evidence01_sttl02.png)
![[安全性]本剤投与群における副作用発現状況](/newtemp/domain/img/newmajor/urece/evidence/pic_evidence01_sttl02_sp.png)