- 医療関係者向けホーム
- 循環器領域
- ユリス®錠
- Pick Up
- 痛風・高尿酸血症の基本と最新知見(テキスト版)
 Pick Up
Pick Up
2021年01月22日公開(2022年03月01日一部改訂)

2020年5月に高尿酸血症治療剤として、ユリス®錠(ドチヌラド)が発売になり、高尿酸血症の薬物療法の選択肢が増えました。ドチヌラドは、腎臓の近位尿細管にあるURAT1を介した尿酸の再吸収経路を選択的に阻害する選択的尿酸再吸収阻害薬(SURI)です。今回は、東京薬科大学の市田公美先生に、高尿酸血症の基本的な内容から尿酸トランスポーターに関する知見、高尿酸血症のSURIによる治療戦略などについて伺いました。
- SURI:Selective Urate Reabsorption Inhibitor : 選択的尿酸再吸収阻害薬
高尿酸血症の定義
高尿酸血症は、尿酸の産生と排泄のバランスが崩れて、体内の尿酸量が過剰になり、血清尿酸値が7.0mg/dLを超えた状態のことを指します1)。
- 1)日本痛風・尿酸核酸学会ガイドライン改訂委員会
高尿酸血症・痛風の治療ガイドライン 第3版 診断と治療社 2018:72-3
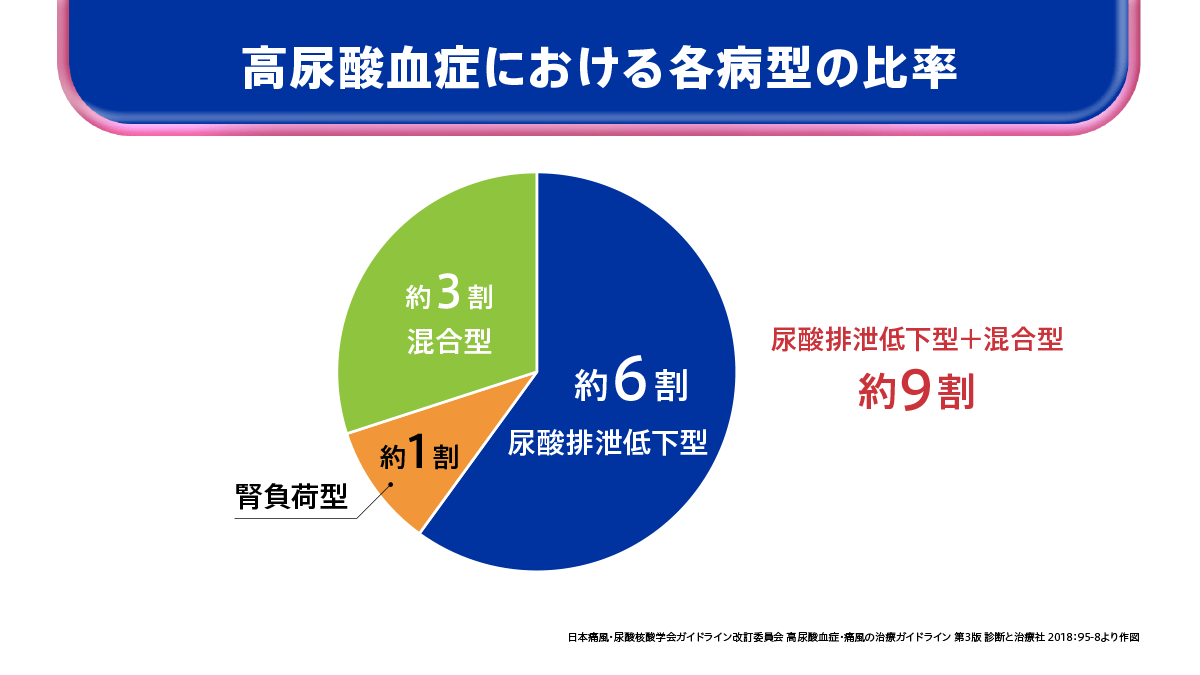
高尿酸血症の病型分類
高尿酸血症の病型は大きく3つに分けられます。
1つ目は腎臓における尿酸排泄効率が低下した「尿酸排泄低下型」、2つ目は腎臓に対する尿酸負荷が増大し、血清尿酸値の上昇をきたす「腎負荷型」、そして3つ目はこれらの「混合型」です。
さらに腎負荷型には、尿酸産生が過剰になった「尿酸産生過剰型」と腸管からの尿酸排泄が低下した「腎外排泄低下型」の2つがあります。
尿酸トランスポーターの種類
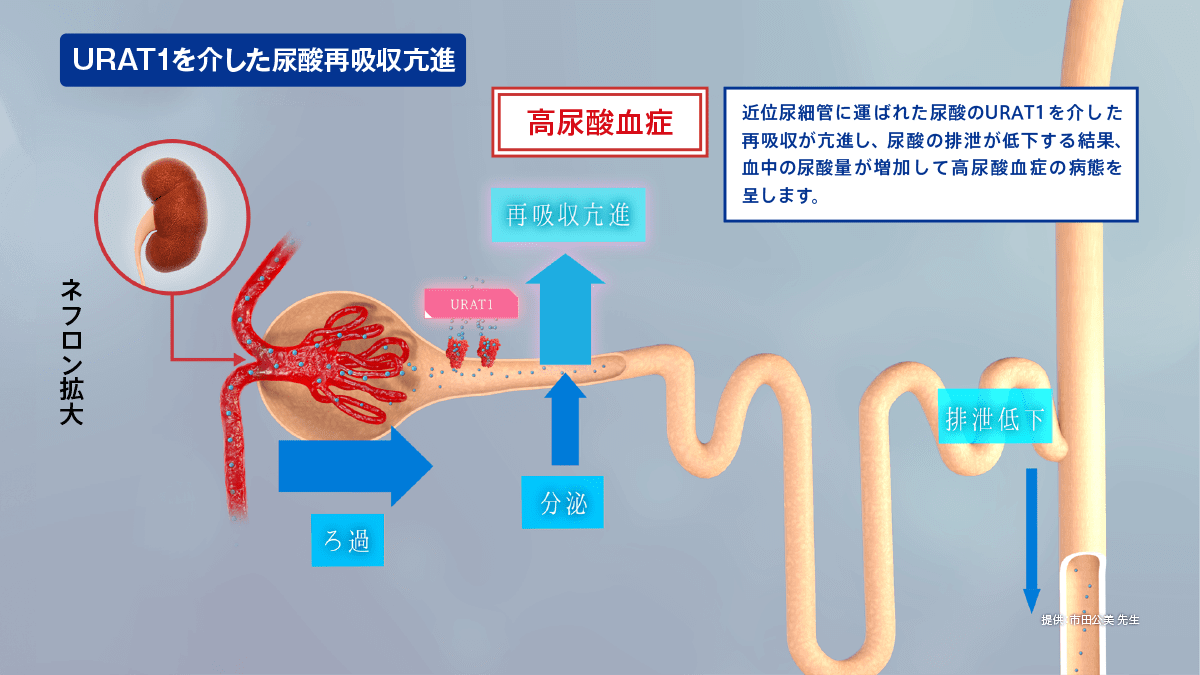
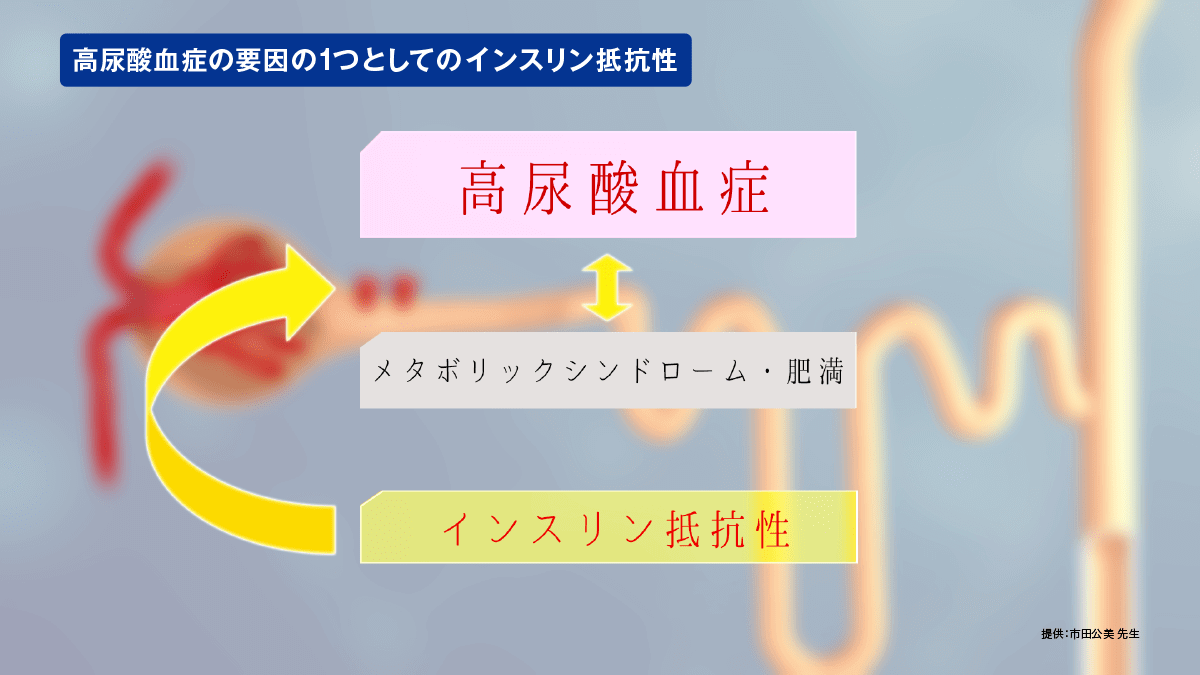
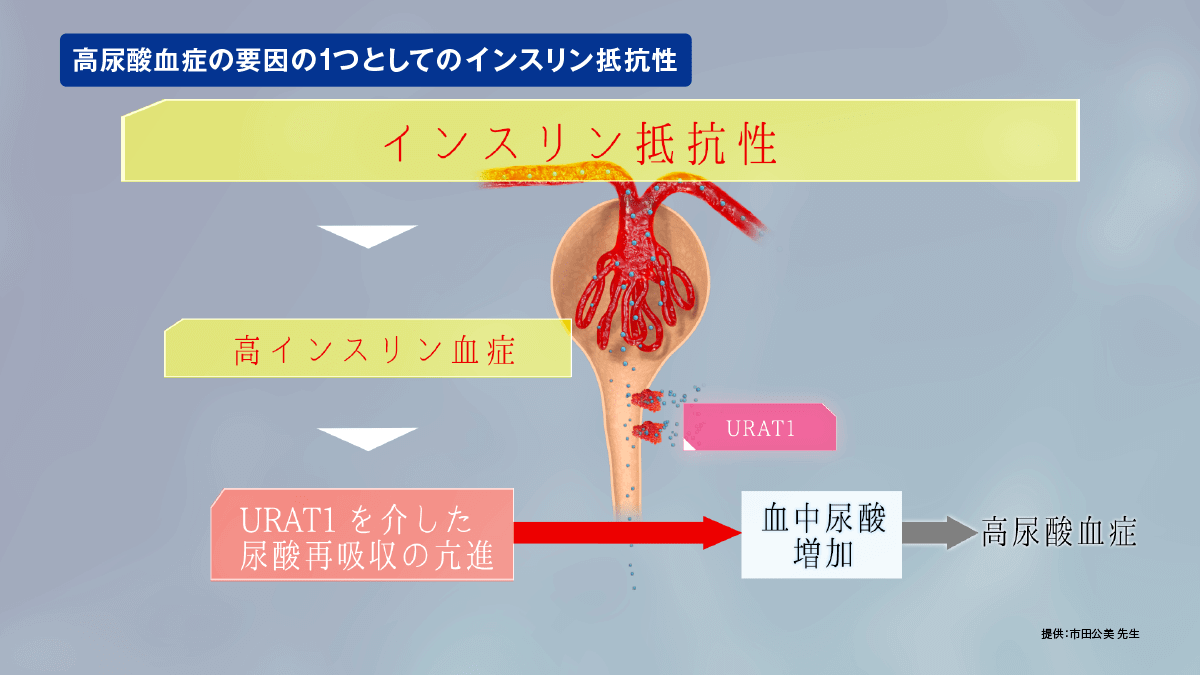
URAT1と高尿酸血症の病態
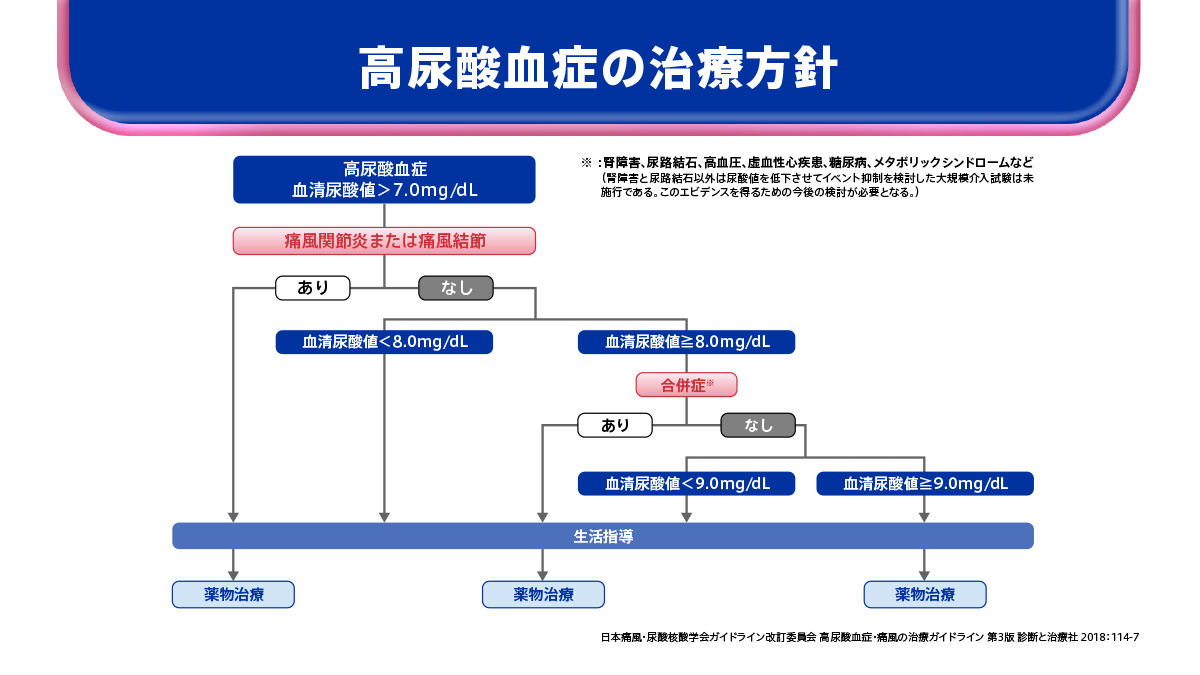
尿酸降下薬の投与開始基準と選択基準
高尿酸血症の治療について、高尿酸血症・痛風の治療ガイドライン第3版ではフローチャートが示されています。
生活習慣の改善を前提に、このフローチャートから尿酸降下薬の開始基準を読み解くと、次のようになります。
〈尿酸降下薬の開始基準〉
- ①血清尿酸値>7.0mg/dLで、痛風関節炎や痛風結節の既往がある場合。
- ②血清尿酸値≧9.0mg/dLの場合。
- ③血清尿酸値≧8.0mg/dL、<9.0mg/dLで腎障害や尿路結石などの合併症がある場合。この場合、患者さんごとに尿酸降下薬の適応があるかどうかを判断する必要がある。
2020年にユリス®錠(ドチヌラド)が登場し、尿酸降下薬は、現在多くの選択肢があります。
従来は、高尿酸血症の病型に応じて使い分けが推奨されていました。しかし、尿酸生成抑制薬が尿酸排泄低下型にも有効であるという報告などがあることから、現在のガイドラインでは、このセオリーについては紹介程度にとどめられています。そのため、病型を含め、総合的に患者さんごとの状況を評価して薬剤を選択しているのが実情です。
ただ理論的には、血清尿酸値を高めている原因を薬剤で改善する、例えば尿酸排泄低下型には尿酸排泄を促すのが合理的と考えます。
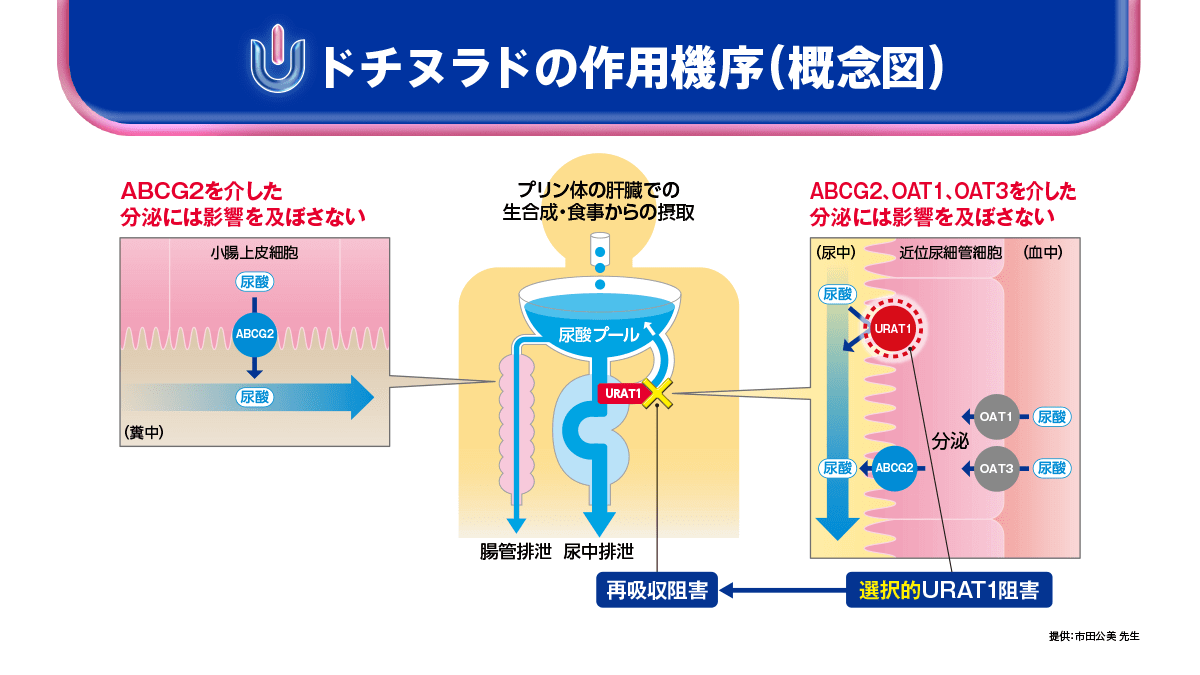
ドチヌラドの薬理学的特徴
ドチヌラドの臨床試験結果
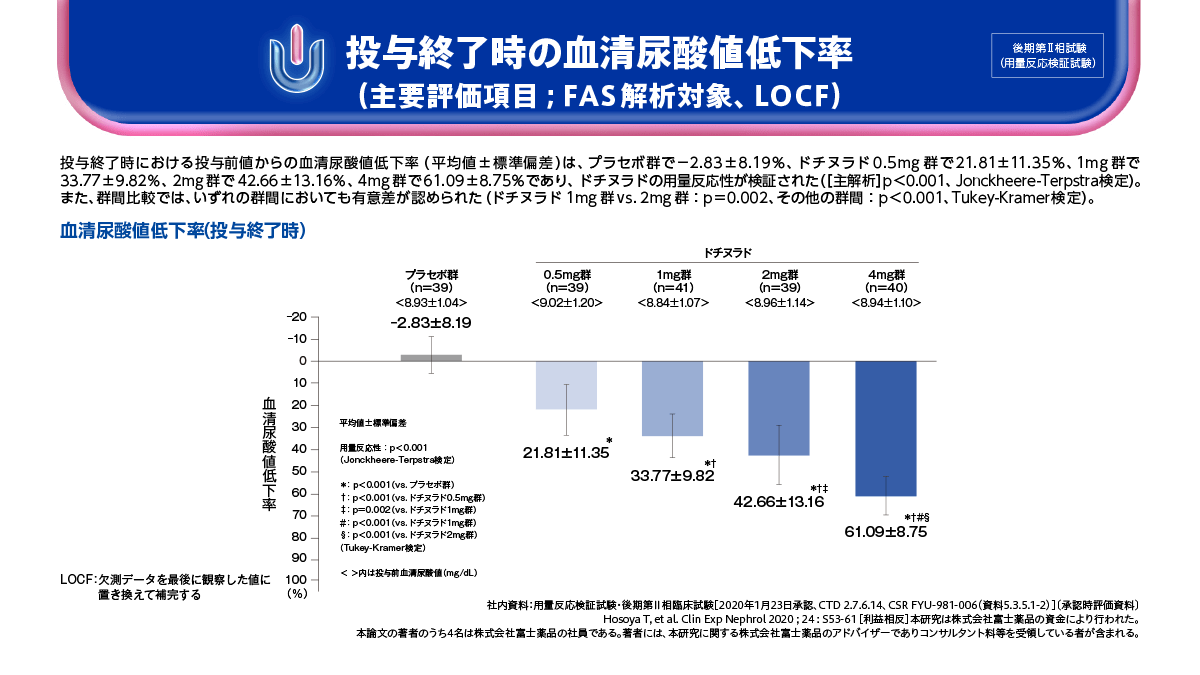
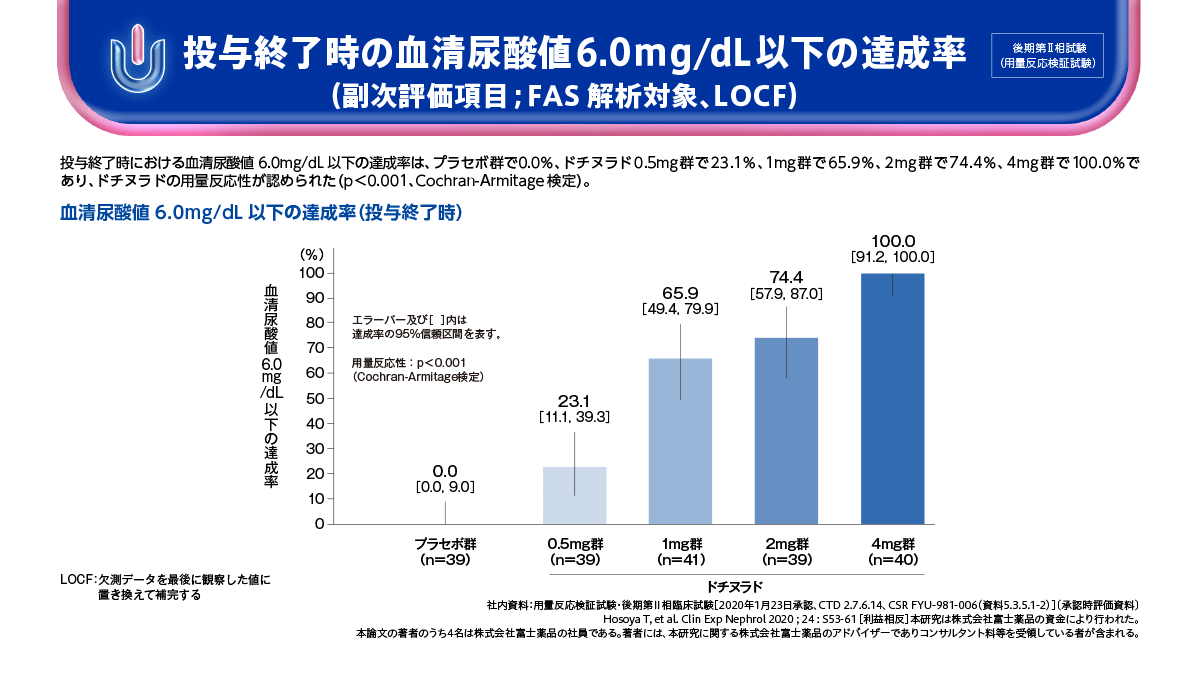
ドチヌラドの後期第Ⅱ相試験では、主要評価項目である投与終了時の血清尿酸値低下率は、ドチヌラド0.5mg群から4mg群において用量反応性が検証されました。また、副次評価項目の血清尿酸値6.0mg/dL以下の達成率は、プラセボ群で0.0%、ドチヌラド0.5mg群で23.1%、1mg群で65.9%、2mg群で74.4%、4mg群で100.0%であり、ドチヌラドの用量反応性が認められました。
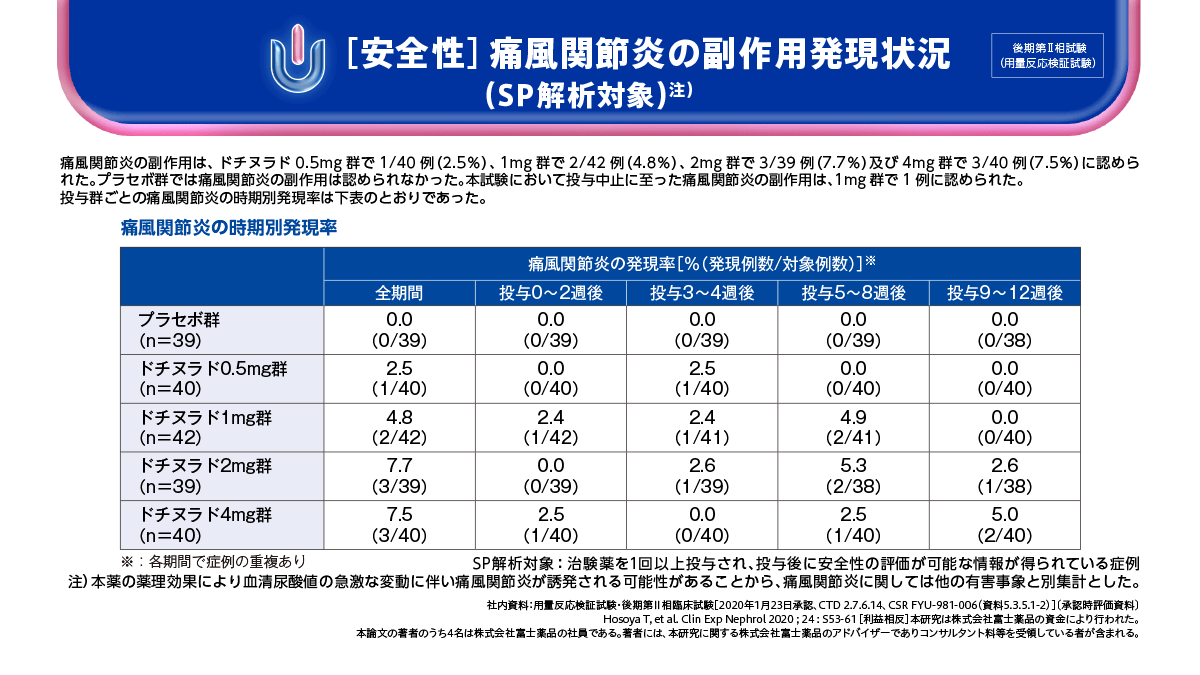
一方、安全性について、急性の痛風関節炎を除く副作用及び急性の痛風関節炎の副作用は、プラセボ群で15.4%及び0.0%、ドチヌラド0.5mg群で12.5%及び2.5%、1mg群で14.3%及び4.8%、2mg群で15.4%及び7.7%、4mg群で10.0%及び7.5%に認められました。
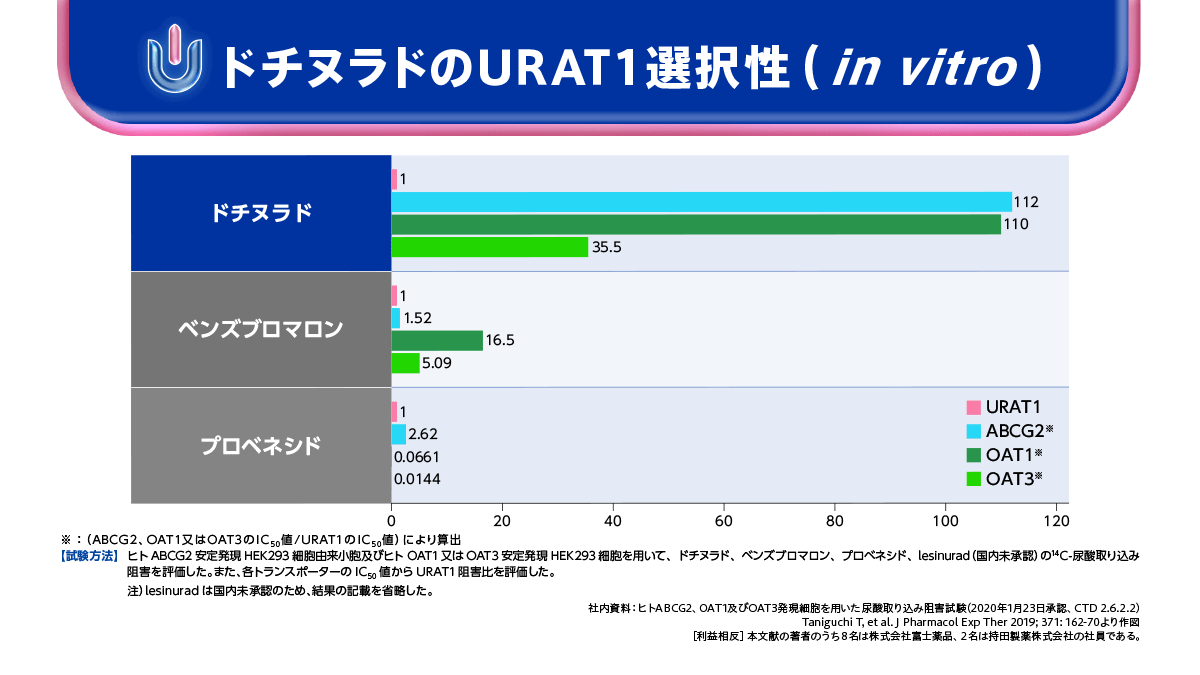
高尿酸血症の発症にはURAT1やABCG2などの尿酸トランスポーターが深く関与しています。
URAT1を介した再吸収亢進は高尿酸血症の病態をきたす要因の1つになると考えられています。また、ABCG2は、その機能が低下すると血清尿酸値が上昇することが想定されます。
ドチヌラドはURAT1選択性が高く、ABCG2やOAT1、OAT3を介した尿酸分泌経路は阻害せず、URAT1を介した再吸収経路を阻害するSURIです。メタボリックシンドロームや肥満を伴う高尿酸血症患者さんをはじめ、これからの痛風・高尿酸血症治療において、ドチヌラドは重要な選択肢の1つとして期待できるものと思われます。
「禁忌を含む使用上の注意」等は添付文書をご参照ください。
後期第Ⅱ相試験(用量反応検証試験)
後期第Ⅱ相試験は一部承認外の成績が含まれますが、用量反応検証試験として実施されたため掲載します。
- 社内資料:用量反応検証試験・後期第Ⅱ相臨床試験[2020年1月23日承認、CTD 2.7.6.14、CSR FYU-981-006(資料5.3.5.1-2)]〔承認時評価資料〕
- Hosoya T, et al. Clin Exp Nephrol 2020 ; 24 : S53-61
- [利益相反] 本研究は株式会社富士薬品の資金により行われた。本論文の著者のうち4名は株式会社富士薬品の社員である。
- 著者には、本研究に関する株式会社富士薬品のアドバイザーでありコンサルタント料等を受領している者が含まれる。
投与終了時の血清尿酸値低下率(主要評価項目;FAS解析対象、LOCF)
ドチヌラド0.5mg群~4mg群において、用量反応性が検証されました。
投与終了時の血清尿酸値6.0mg/dL以下の達成率
(副次評価項目;FAS解析対象、LOCF)
ドチヌラド0.5mg群~4mg群において、用量反応性が認められました。
安全性(SP解析対象)注)
痛風関節炎を除く副作用(臨床検査値異常を含む)及び痛風関節炎の副作用は、プラセボ群で15.4%及び0.0%、ドチヌラド0.5mg群で12.5%及び2.5%、1mg群で14.3%及び4.8%、2mg群で15.4%及び7.7%、4mg群で10.0%及び7.5%に認められました。
痛風関節炎を除く副作用(臨床検査値異常を含む)は、プラセボ群で6/39例(15.4%)、ドチヌラド0.5mg 群で5/40 例(12.5%)、1mg 群で6/42 例(14.3%)、2mg 群で6/39例(15.4%)、4mg 群で4/40例(10.0%)に認められました。そのうち、2例以上に発現した副作用は、プラセボ群で尿中β2ミクログロブリン増加2/39例(5.1%)、ドチヌラド1mg群でβ‒NアセチルDグルコサミニダーゼ増加3/42例(7.1%)、2mg群で尿中β2ミクログロブリン増加、β‒NアセチルDグルコサミニダーゼ増加、白血球数増加各2/39例(5.1%)、4mg群で尿中β2ミクログロブリン増加、β‒NアセチルDグルコサミニダーゼ増加、α1ミクログロブリン増加各2/40例(5.0%)でした。
ドチヌラド0.5mg群では、四肢不快感、γ‒グルタミルトランスフェラーゼ増加等が各1/40例(2.5%)に認められました。
死亡例を含む重篤な副作用は認められず、投与中止に至った痛風関節炎を除く副作用は、プラセボ群で尿中β2ミクログロブリン増加が1例に認められました。
【用法及び用量】
通常、成人にはドチヌラドとして1日0.5mgより開始し、1日1回経口投与する。その後は血中尿酸値を確認しながら必要に応じて徐々に増量する。維持量は通常1日1回2mgで、患者の状態に応じて適宜増減するが、最大投与量は1日1回4mgとする。
コンテンツ評価にご協力をお願いいたします。
このコンテンツは参考になりましたでしょうか?
ご回答ありがとうございます。
マイページ設定により、先生のご興味のある領域/製品の最新情報を
効率的にチェックすることができます!
今後のコンテンツ改善のために、
「参考にならなかった」理由を
教えてください。
(複数回答可)

引き続き、持田製薬 医療関係者向けサイトを
よろしくお願いいたします。