- 医療関係者向けホーム
- 消化器領域
- オンボー®
- Support:投与スケジュール
 Support投与スケジュール
Support投与スケジュール
投与スケジュール
潰瘍性大腸炎
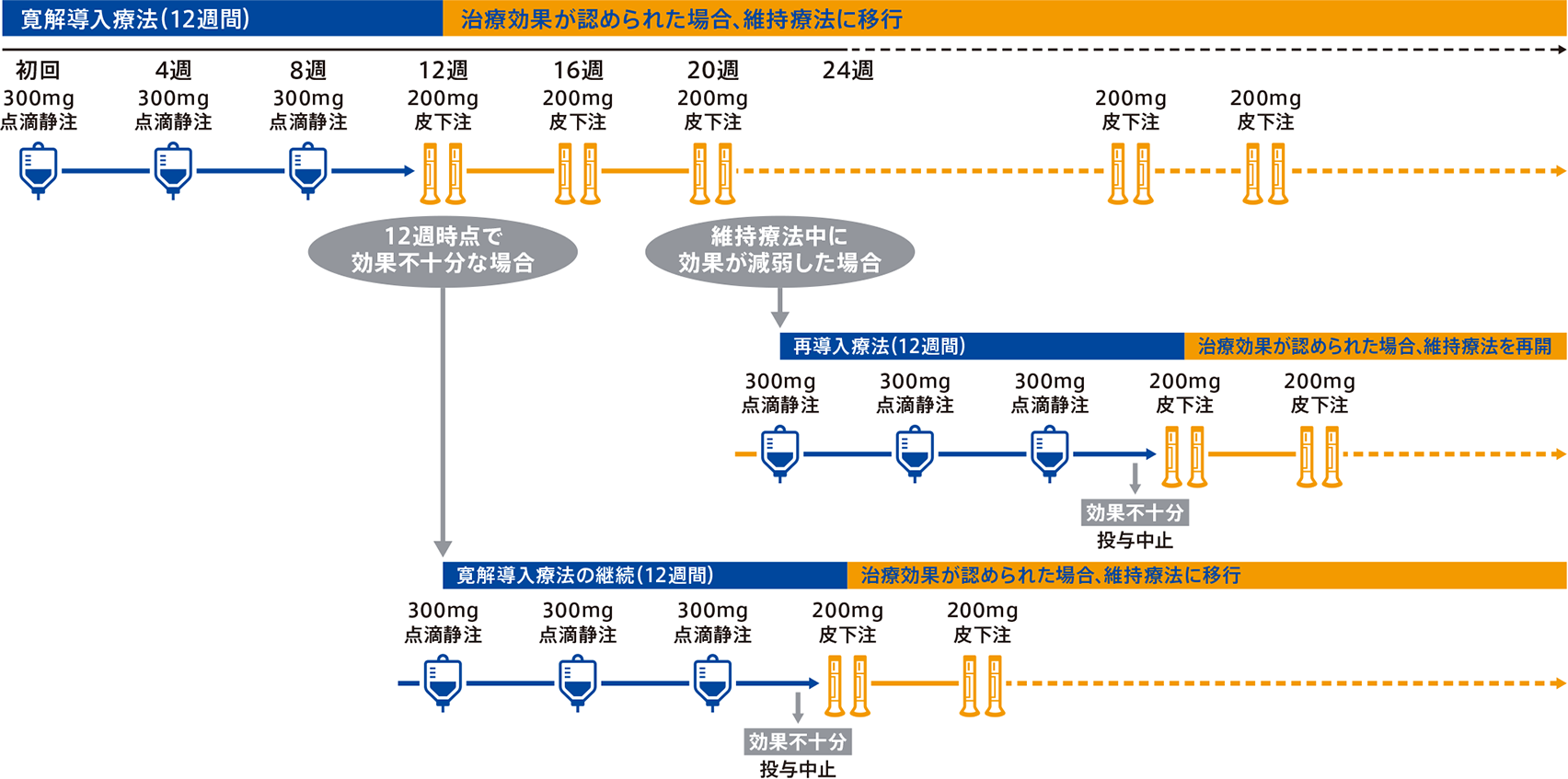
寛解導入療法として1回300mgを4週間隔で3回点滴静注した後、維持療法として1回200mg(100mg製剤2本)を4週間隔で皮下投与します。
- ・維持療法では、医師の管理のもとで自己注射が可能です。
- ・皮下注製剤にはオートインジェクターとシリンジがあります。
オンボー®点滴静注の用法及び用量(抜粋)
〈潰瘍性大腸炎〉
通常、成人にはミリキズマブ(遺伝子組換え)として、1回300mgを4週間隔で3回(初回、4週、8週)点滴静注する。なお、12週時に効果不十分な場合はさらに1回300mgを4週間隔で3回(12週、16週、20週)投与することができる。
また、ミリキズマブ(遺伝子組換え)皮下投与用製剤による維持療法中に効果が減弱した場合には、1回300mgを4週間隔で3回点滴静注することができる。
オンボー®点滴静注の用法及び用量に関連する注意(抜粋)
〈効能共通〉
- 7.1本剤と他の生物製剤又はヤヌスキナーゼ(JAK)阻害剤との併用について安全性及び有効性は確立していないので併用を避けること。
〈潰瘍性大腸炎〉
- 7.2本剤の3回目又は6回目投与の4週後に治療効果が得られた場合には、維持療法としてミリキズマブ(遺伝子組換え)皮下投与用製剤の投与を開始すること(維持療法における用法及び用量は、ミリキズマブ(遺伝子組換え)皮下投与用製剤の電子添文を参照すること)。本剤の6回目投与の4週後までに治療効果が得られない場合には、本剤の投与を中止し、他の治療法への切替えを考慮すること。
- 7.3ミリキズマブ(遺伝子組換え)皮下投与用製剤による維持療法中に効果が減弱し、本剤の3回投与により治療効果が得られた場合には、3回目投与の4週後から皮下投与用製剤の投与を再開すること。治療効果が得られない場合は、本剤の投与を中止し、他の治療法への切替えを考慮すること。また、皮下投与用製剤による維持療法中に再び効果が減弱した場合には、他の治療法への切替えを考慮すること。維持療法中の2回目以降の効果減弱時に、本剤を投与した場合の安全性及び有効性を評価する臨床試験は実施していない。
オンボー®皮下注の用法及び用量(抜粋)
オンボー®皮下注 100mg オートインジェクター
オンボー®皮下注 100mg シリンジ
〈潰瘍性大腸炎〉
ミリキズマブ(遺伝子組換え)点滴静注製剤による導入療法終了4週後から、通常、成人にはミリキズマブ(遺伝子組換え)として1回200mgを4週間隔で皮下投与する。
オンボー®皮下注の用法及び用量に関連する注意(抜粋)
〈効能共通〉
- 7.1本剤と他の生物製剤又はヤヌスキナーゼ(JAK)阻害剤との併用について安全性及び有効性は確立していないので併用を避けること。
- 7.2100mg製剤と200mg製剤の生物学的同等性は示されていない。200mg製剤はクローン病のみに使用すること。
〈潰瘍性大腸炎〉
- 7.3本剤による維持療法中に効果が減弱し、ミリキズマブ(遺伝子組換え)点滴静注製剤3回投与により治療効果が得られた場合には、3回目投与の4週後から本剤の皮下投与を再開すること(効果減弱時における用法及び用量は、ミリキズマブ(遺伝子組換え)点滴静注製剤の電子添文を参照すること)。また、本剤による維持療法中に再び効果が減弱した場合には、他の治療法への切替えを考慮すること。維持療法中の2回目以降の効果減弱時に、ミリキズマブ(遺伝子組換え)点滴静注製剤を投与した場合の安全性及び有効性を評価する臨床試験は実施していない。
- 7.4ミリキズマブ(遺伝子組換え)200mgを投与するために、本剤100mg製剤2本を皮下に投与すること。
クローン病
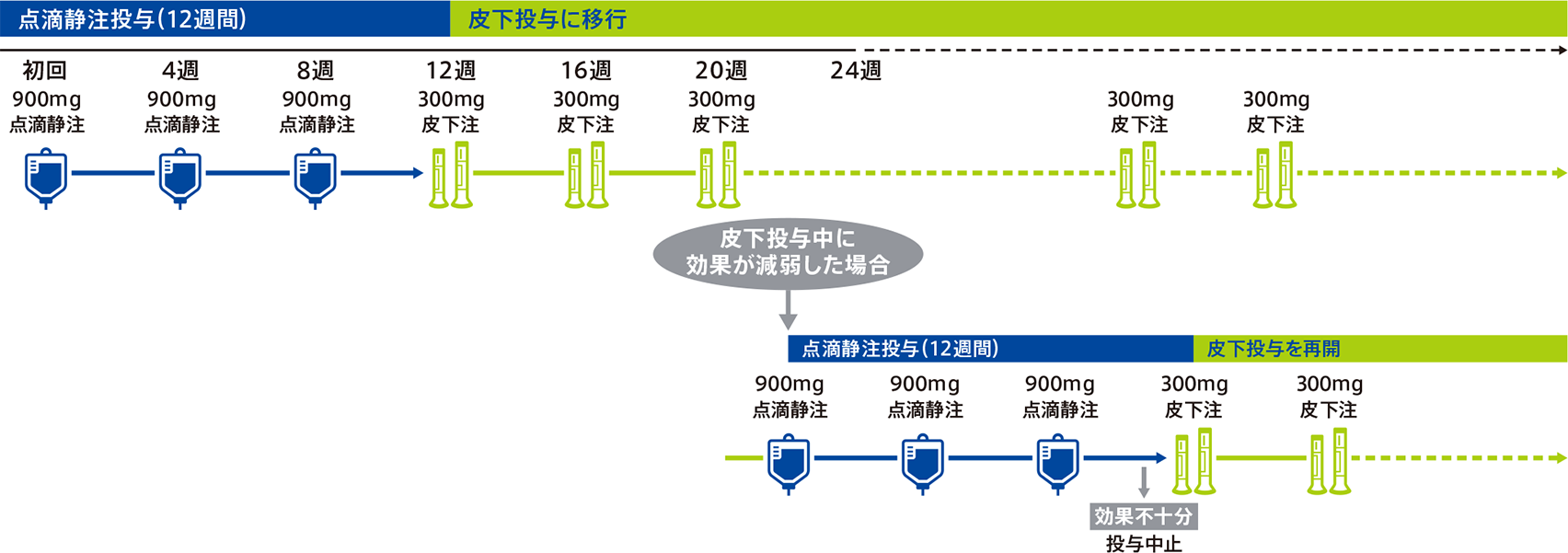
1回900mgを4週間隔で3回点滴静注した後、1回300mg(100mg製剤1本と200mg製剤1本の合計2本)を4週間隔で皮下投与します。
- ・皮下投与では、医師の管理のもとで自己注射が可能です。
- ・皮下注製剤にはオートインジェクターとシリンジがあります。
オンボー®点滴静注の用法及び用量(抜粋)
〈クローン病〉
通常、成人にはミリキズマブ(遺伝子組換え)として、1回900mgを4週間隔で3回(初回、4週、8週)点滴静注する。
また、ミリキズマブ(遺伝子組換え)皮下投与用製剤による治療中に効果が減弱した場合には、1回900mgを4週間隔で3回点滴静注することができる。
オンボー®点滴静注の用法及び用量に関連する注意(抜粋)
〈効能共通〉
- 7.1本剤と他の生物製剤又はヤヌスキナーゼ(JAK)阻害剤との併用について安全性及び有効性は確立していないので併用を避けること。
〈クローン病〉
- 7.4本剤の3回目投与の4週後にミリキズマブ(遺伝子組換え)皮下投与用製剤の投与を開始すること(皮下投与用製剤による治療の用法及び用量は、ミリキズマブ(遺伝子組換え)皮下投与用製剤の電子添文を参照すること)。本剤による治療開始から24週後までに効果が得られない場合には、投与継続の必要性を検討すること。
- 7.5ミリキズマブ(遺伝子組換え)皮下投与用製剤による治療中に効果が減弱し、再度の本剤の3回投与により治療効果が得られた場合には、3回目投与の4週後から皮下投与用製剤の投与を再開すること。再度の本剤の3回投与の4週後に治療効果が得られない場合は、本剤の投与を中止し、他の治療法への切替えを考慮すること。また、皮下投与用製剤による治療中に再び効果が減弱した場合には、他の治療法への切替えを考慮すること。皮下投与用製剤による治療中の2回目以降の効果減弱時に、本剤を投与した場合の安全性及び有効性を評価する臨床試験は実施していない。
オンボー®皮下注の用法及び用量(抜粋)
オンボー®皮下注100mgオートインジェクター
オンボー®皮下注100mgシリンジ
オンボー®皮下注200mgオートインジェクター
オンボー®皮下注200mgシリンジ
〈クローン病〉
ミリキズマブ(遺伝子組換え)点滴静注製剤による治療終了4週後から、通常、成人にはミリキズマブ(遺伝子組換え)として1回300mgを4週間隔で皮下投与する。
オンボー®皮下注の用法及び用量に関連する注意(抜粋)
〈効能共通〉
- 7.1本剤と他の生物製剤又はヤヌスキナーゼ(JAK)阻害剤との併用について安全性及び有効性は確立していないので併用を避けること。
- 7.2100mg製剤と200mg製剤の生物学的同等性は示されていない。200mg製剤はクローン病のみに使用すること。
〈クローン病〉
- 7.5ミリキズマブ(遺伝子組換え)治療開始から24週後までに効果が得られない場合には、投与継続の必要性を検討すること。
- 7.6本剤の皮下投与による治療中に効果が減弱し、再度のミリキズマブ(遺伝子組換え)点滴静注製剤の3回投与により治療効果が得られた場合には、3回目投与の4週後から本剤の皮下投与を再開すること(効果減弱時における用法及び用量は、ミリキズマブ(遺伝子組換え)点滴静注製剤の電子添文を参照すること)。また、本剤の皮下投与による治療中に再び効果が減弱した場合には、他の治療法への切替えを考慮すること。本剤の皮下投与による治療中の2回目以降の効果減弱時に、ミリキズマブ(遺伝子組換え)点滴静注製剤を投与した場合の安全性及び有効性を評価する臨床試験は実施していない。
- 7.7ミリキズマブ(遺伝子組換え)300mgを投与するために、1回につき本剤100mg製剤1本と本剤200mg製剤1本の合計2本を任意の順で皮下に投与すること。