- 医療関係者向けホーム
- その他領域
- ペグフィルグラスチムBS「モチダ」
- Information:薬物動態
 Information
Information
薬効薬理
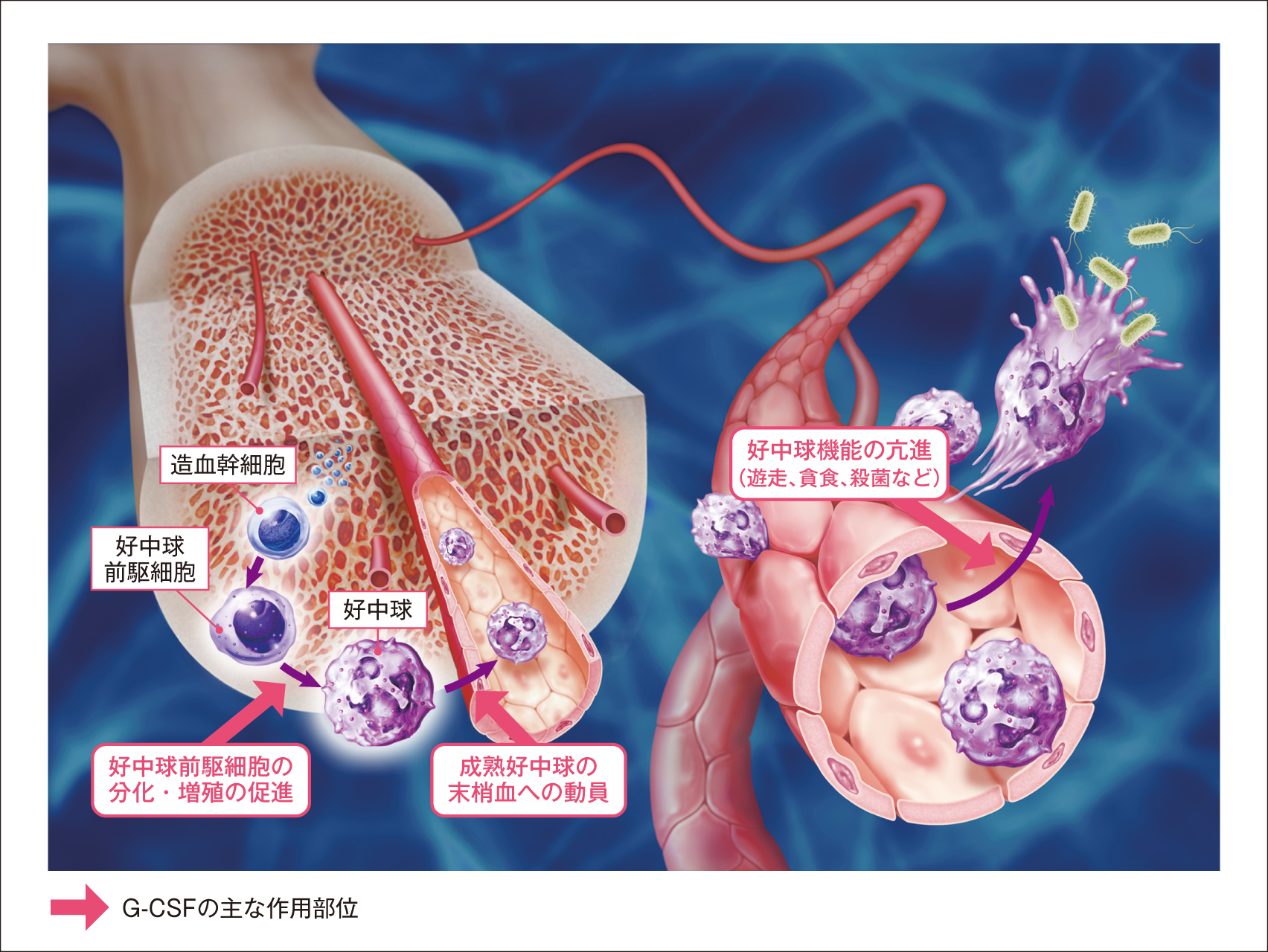
作用機序
ペグフィルグラスチムはフィルグラスチムのN末端にPEGを結合させたG-CSF製剤である。
ペグフィルグラスチムは、フィルグラスチムと同様に骨髄中の好中球前駆細胞に存在するG-CSF受容体に結合し、好中球前駆細胞から好中球への分化を促すとともに、成熟好中球を末梢血中へ動員することで好中球数を増加させると推察される。また、好中球の遊走能や貪食殺菌能などの機能を亢進させると考えられている1, 2)。
- 髙橋萌々子 他:Drug Delivery System 2017;32:134-42
- 北川誠一 他:Biotherapy 1992;6:20-8 より作図
非臨床試験
G-CSF依存性細胞における増殖促進作用(in vitro)3)
G-CSF依存性増殖を示すマウスNFS-60細胞株を用いて、本剤及びジーラスタ®の細胞増殖促進作用を検討した。
その結果、いずれも濃度依存的な細胞増殖促進作用を示し、WHO標準品を対照として算出した比活性は本剤(0.97~1.20×107IU/mg)、ジーラスタ®(0.92~1.18×107IU/mg)であった。
好中球数増加作用(マウス)4)
7週齢の雄性Crl:CD1(ICR)マウスに本剤又はジーラスタ®をそれぞれ30、100及び300μg/kgの用量で単回皮下投与し、投与前日及び投与後0~7日目の末梢血中の好中球数を測定した。対照群として、溶媒を投与する溶媒対照群を設定した。
その結果、本剤群及びジーラスタ®群のいずれの用量においても、投与当日、投与後1日目、投与後2日目に溶媒対照群に比べて有意に好中球数が増加した(p値<0.01、Dunnettの多重比較検定)。
本試験の結果から、正常マウスにおける本剤の末梢血好中球数増加作用はジーラスタ®と類似していると考えられた。
好中球減少に対する作用(好中球減少症モデルマウス)4)
7週齢の雄性Crl:CD1(ICR)マウスにシクロホスファミド(CPA)260mg/kgを単回腹腔内投与し、好中球減少症モデルを作製した。CPA投与後0、1、2又は3日目に本剤300μg/kgを単回皮下投与し、CPA投与前日及び投与後1~7、10及び13日目の末梢血中の好中球数を測定した。対照群として、CPA及び被験物質を投与しない無処置群と、CPA投与後0日目に溶媒を投与する溶媒対照群を設定した。
その結果、CPA投与後3~6日目において、CPA投与後0~3日目に本剤を投与したいずれの群でも溶媒対照群と比較して好中球数の有意な上昇が認められた(p値<0.01、Dunnettの多重比較検定)。
臨床薬理試験5)
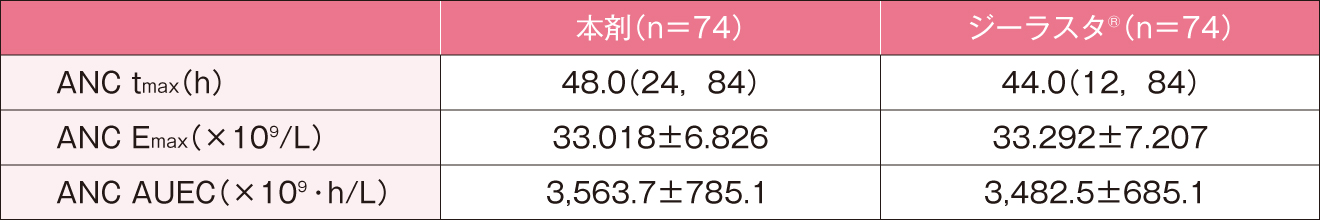
好中球数増加作用(薬力学的同等性試験)
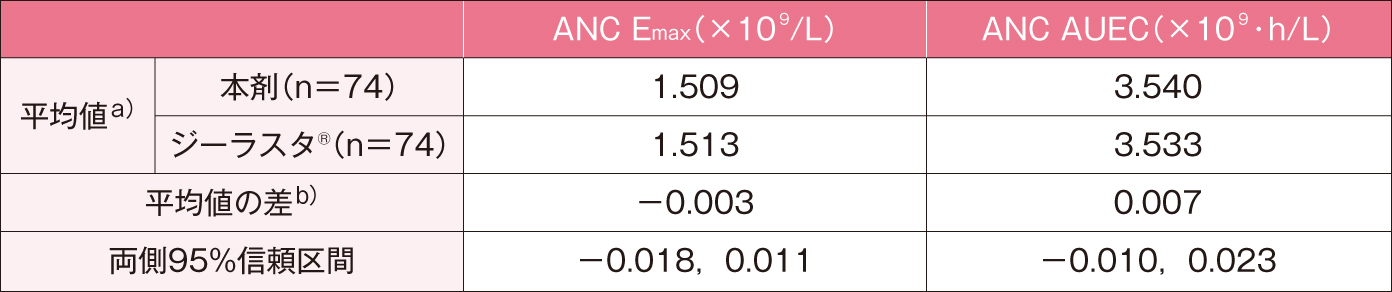
健康成人男性に本剤又はジーラスタ®3.6mgをクロスオーバー法により単回皮下投与したときのANCの推移及び薬力学的パラメータは以下のとおりであった。本剤投与時とジーラスタ®投与時のANC Emax及びANC AUECの常用対数変換値の平均値の差はそれぞれ-0.003(log0.992)及び0.007(log1.016)であり、両側95%信頼区間はそれぞれ[-0.018(log0.960),0.011(log1.025)]及び[-0.010(log0.977),0.023(log1.056)]で、治験実施計画書で定められた同等性許容域である-0.097(log0.80)~0.097(log1.25)の範囲内であったことから、本剤とジーラスタ®の薬力学的効果の同等性が確認された。
- 平均値±標準偏差[tmaxは中央値(最小値,最大値)]
- a)常用対数変換した値
- b)平均値の差=(本剤の平均値)-(ジーラスタ®の平均値)
安全性
本剤投与時及びジーラスタ®投与時の副作用の発現率は、それぞれ91.0%(71/78例)及び92.1%(70/76例)であった。いずれかの投与時の発現率が5%以上であった副作用(本剤投与時の発現率、ジーラスタ®投与時の発現率[以下、同順で表記])は、血中乳酸脱水素酵素増加(64.1%[50/78例]、50.0%[38/76例])、血中Al-P増加(61.5%[48/78例]、52.6%[40/76例])、背部痛(46.2%[36/78例]、47.4%[36/76例])、血中尿酸増加(30.8%[24/78例]、26.3%[20/76例])、頭痛(20.5%[16/78例]、25.0%[19/76例])、倦怠感(9.0%[7/78例]、7.9%[6/76例])、筋骨格不快感(6.4%[5/78例]、11.8%[9/76例])、筋肉痛(3.8%[3/78例]、6.6%[5/76例])であった。
本試験において、死亡に至った副作用、重篤な副作用、治験中止に至った副作用は認められなかった。
抗薬物抗体陽性例は、本剤投与時及びジーラスタ®投与時に1例ずつ認められ、同一被験者であった。
【対象・方法】
ランダム化二重盲検2剤2期クロスオーバー法により、20歳以上40歳以下の健康成人男性74例を対象に本剤又はジーラスタ®3.6mgを単回皮下投与し、最大好中球絶対数到達時間(ANC tmax)、最大好中球絶対数(ANC Emax)、好中球絶対数―時間曲線下面積(ANC AUEC)を測定した。
安全性については、安全性解析対象集団80例(本剤投与時78例、ジーラスタ®投与時76例)を対象に副作用発現率を算出した。
- 1)髙橋萌々子 他:Drug Delivery System 2017;32:134-42
- 2)北川誠一 他:Biotherapy 1992;6:20-8
- 3)持田製薬社内資料:薬理試験-ペグフィルグラスチムBSのin vitro薬理試験-
- 4)持田製薬社内資料:薬理試験-ペグフィルグラスチムBSのin vivo薬理試験-
- 5)持田製薬社内資料:第Ⅰ相試験〔承認時評価資料〕