- 医療関係者向けホーム
- 消化器領域
- コレチメント®錠
- Clinical Study:CORE Ⅰ試験(海外第Ⅲ相試験) 海外データ 試験概要
 Clinical StudyCORE Ⅰ試験(海外第Ⅲ相試験) 海外データ
Clinical StudyCORE Ⅰ試験(海外第Ⅲ相試験) 海外データ
「CORE Ⅰ試験(海外第Ⅲ相試験)海外データ」
本試験には、一部、本邦承認外となる用量の投与群が含まれています。
コレチメント6mg/日群の有効性の成績は削除しています。
本試験成績は、コレチメント®群と参照群(pH依存型メサラジン放出調節製剤2400mg)との比較を示したものではありません。
- 社内資料:海外第Ⅲ相試験(2023年6月26日承認、CTD 2.7.6.8)〈承認時評価資料〉
- Sandborn, W.J. et al.:Gastroenterology. 2012;143(5):1218-1226.e2
- 本論文の著者には、過去に製造販売元のフェリング・ファーマ株式会社が資金提供を行った者が含まれています。
試験概要
「禁忌を含む注意事項等情報」等については製品情報(DI)をご参照ください。
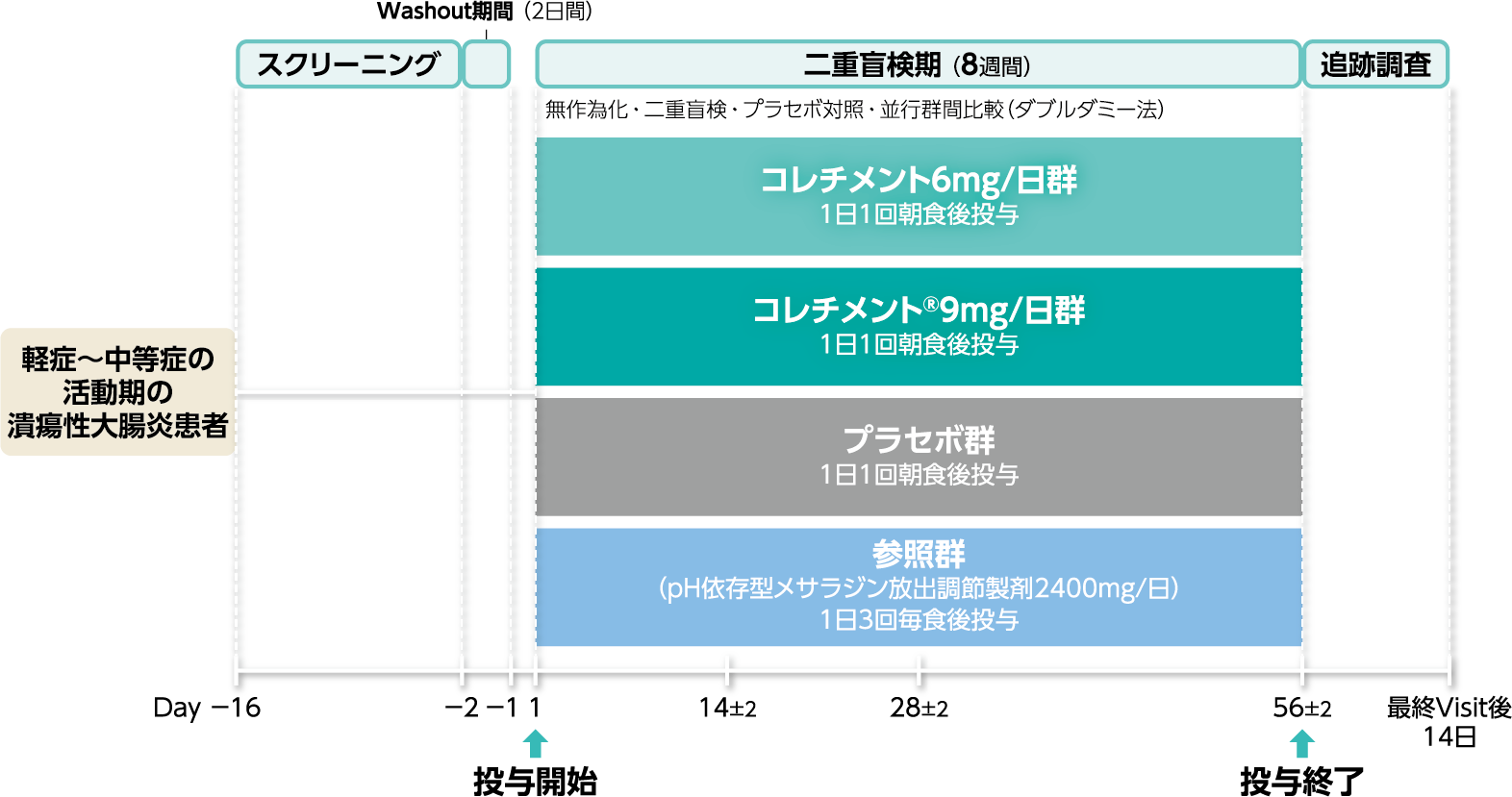
試験デザイン
第Ⅲ相・多施設共同・無作為化・二重盲検・プラセボ対照・並行群間比較試験(ダブルダミー法)
目的
軽症~中等症の活動期潰瘍性大腸炎患者を対象に、コレチメント®9mg/日を8週間経口投与した際の有効性および安全性について、プラセボを対照に評価する。なお、pH依存型メサラジン放出調節製剤2400mg/日は参照薬として、有効性および安全性を探索的に評価する。
対象
外国人の軽症~中等症の活動期潰瘍性大腸炎患者〔安全性解析対象集団:509例、ITT(Intention-to-treat)解析対象集団:489例〕
- 【選択基準】①潰瘍性大腸炎罹患歴:6ヵ月間以上 ②UCDAI(Ulcerative Colitis Disease Activity Index)〈Sutherland Index〉 総スコアが4〜10の軽症~中等症の活動期潰瘍性大腸炎 ③18〜75歳 ④有効性評価のため、内視鏡により採取した標本で、組織学的に活動性病変を有する
方法
スクリーニング後、使用中の潰瘍性大腸炎治療剤を中止し、2日間のWashout期間終了後に、対象患者を無作為にコレチメント6mg/日群(1日1回朝食後投与)、コレチメント®9mg/日群(1日1回朝食後投与)、プラセボ群(1日1回朝食後投与)、参照群(pH依存型メサラジン放出調節製剤2400mg/日:1日3回毎食後投与)の4群に割り付け、二重盲検下でダブルダミー法を用いて8週間投与した。
評価項目
- 〈有効性〉
-
- ◎主要評価項目:
- 投与後8週時に臨床的・内視鏡的寛解※1が認められた被験者の割合(検証的解析項目)
- ◎副次評価項目:
- 投与後8週時に臨床的改善※2が認められた被験者の割合 など
- 〈安全性〉
-
- ◎安全性評価項目:
- 有害事象、臨床検査(血漿中コルチゾール濃度を含む)、糖質コルチコイド作用 など
解析計画
解析対象集団は、有効性評価項目の主解析ではITT解析対象集団※3、安全性では安全性解析対象集団※4とした。なお、欠測値の取扱いについては、有効性の主要評価項目ではWorst case※5を用いた。主要評価項目の解析についてはχ2検定を用い、両側有意水準α=0.025でコレチメント®群とプラセボ群を比較した。なお、本試験では、参照群(pH依存型メサラジン放出調節製剤2400mg/日)とコレチメント®群の統計学的な有意差を示す検出力を設定していないため、両群間の正式な比較は実施しなかった。プラセボ群に対する参照群(pH依存型メサラジン放出調節製剤2400mg/日)の有効性については、コレチメント®群とプラセボ群の比較に用いた解析と同様の解析法を用い、両側有意水準α=0.05で探索的に解析した。
- ※1:UCDAI総スコアが1以下で、UCDAIの血便サブスコア・排便回数サブスコア・粘膜所見サブスコアが0、内視鏡的粘膜所見(Rachmilewitzスコアによる重症度判定)のスコアがベースラインから1以上減少
- ※2:UCDAI総スコアがベースラインから3以上減少
- ※3:無作為割り付けされ、治験薬を少なくとも1回投与された全ての被験者のうち、GCP違反および重大な選択・除外基準違反があった被験者、ならびにベースライン時に組織学的に正常粘膜であった被験者を除く集団
- ※4:治験薬を少なくとも1回投与された被験者集団
- ※5:データ欠測により当該評価ができなかった被験者は、エンドポイントを満たさなかったと評価した
- ●コレチメント®の【6. 用法及び用量】
- 通常、成人にはブデソニドとして9mgを1日1回朝経口投与する。
- ●pH依存型メサラジン放出調節製剤の【6. 用法及び用量】
- 通常、成人にはメサラジンとして1日2,400mgを3回に分けて食後経口投与するが、寛解期には、必要に応じて1日1回2,400mg食後経口投与とすることができる。活動期には、1日3,600mgを3回に分けて食後経口投与する。
なお、患者の状態により適宜減量する。
2024年9月作成
17309-6/N4 B2 MDC