- 医療関係者向けホーム
- 消化器領域
- コレチメント®錠
- Clinical Study:国内第Ⅲ相試験 試験概要
 Clinical Study国内第Ⅲ相試験
Clinical Study国内第Ⅲ相試験
「国内第Ⅲ相試験」
本試験は、非劣性試験としての分析感度が保証されているとはいえず、
本試験成績から本剤の有効性を評価することには限界がありますが、
承認時評価資料のため紹介いたします。
本試験には、一部、本邦承認外となる用量の投与群が含まれています。
コレチメント6mg/日群の有効性の成績は削除しています。
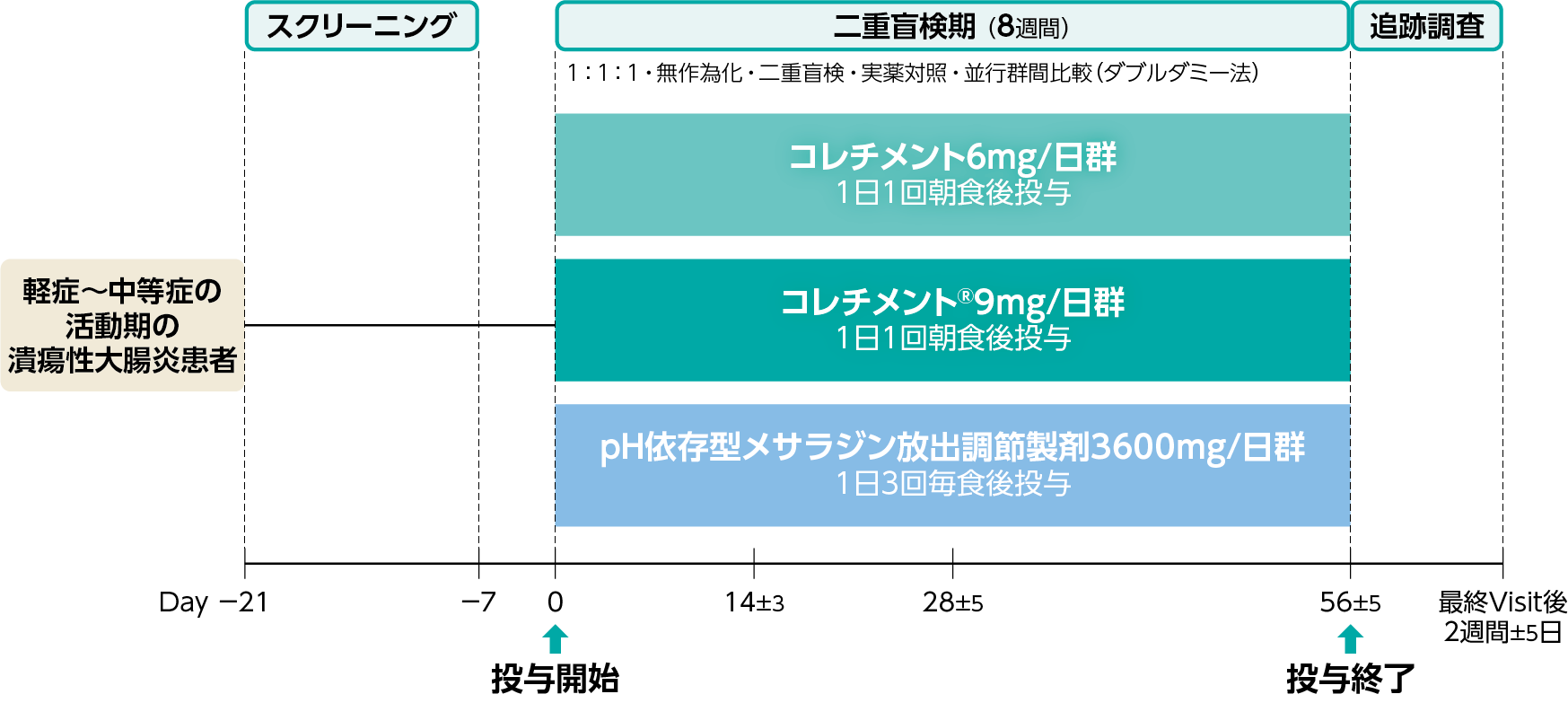
試験デザイン
第Ⅲ相・多施設共同・無作為化・二重盲検・実薬対照・並行群間比較試験(ダブルダミー法)
目的
軽症~中等症の活動期潰瘍性大腸炎患者を対象に、コレチメント®9mg/日を8週間経口投与した際の有効性について、pH依存型メサラジン放出調節製剤3600mg/日に対する「非劣性」を検証する。
対象
日本人の軽症~中等症の活動期潰瘍性大腸炎患者
〔FAS(最大の解析対象集団)、ITT(Intention-to-treat)解析対象集団、安全性解析対象集団:274例〕
- 【選択基準】①潰瘍性大腸炎罹患歴:6ヵ月間以上 ②UCDAI(Ulcerative Colitis Disease Activity Index)〈Sutherland Index〉 総スコアが3~8、かつUCDAIの血便サブスコアが1以上の軽症~中等症の活動期潰瘍性大腸炎 ③16~75歳(同意取得時)
方法
スクリーニング後、対象患者を無作為にコレチメント6mg/日群(1日1回朝食後投与)、コレチメント® 9mg/日群(1日1回朝食後投与)、pH依存型メサラジン放出調節製剤3600mg/日群(1日3回毎食後投与)の3群に割り付け、二重盲検下でダブルダミー法を用いて8週間投与した。なお、本試験前から被験者が5-アミノサリチル酸(5-ASA)経口剤を継続して使用している場合は、スクリーニング来院後から初回の治験薬投与日(Day 0)の1日前まで同量または減量した投与量で投与を継続できることとし(増量は不可)、Day 0の5-ASA経口剤の投与は不可とした。さらに、スクリーニング期間中は、新規の潰瘍性大腸炎治療の開始、ならびに継続中の潰瘍性大腸炎治療剤の用量増量は不可とした。
評価項目
- 〈有効性〉
-
- ◎主要評価項目:
- 投与後8週時のUCDAI総スコアのベースラインからの変化量
(独立中央判定委員会の判定による粘膜所見サブスコアを使用)
〈検証的解析項目〉
- ◎副次評価項目:
- 投与後8週時に臨床的・内視鏡的寛解※1が認められた被験者の割合 など
- 〈安全性〉
-
- ◎安全性評価項目:
- 有害事象、臨床検査(血漿中コルチゾール濃度を含む)、糖質コルチコイド作用 など
解析計画
解析対象集団は、有効性評価項目の主解析ではFAS※2、安全性では安全性解析対象集団※3とした。投与後8週時にUCDAI総スコアが欠測の場合、Last Observation Carried Forward(LOCF)を用いて欠測値を補完した。なお、FAS試験完了例(Completer)を対象とした解析では、欠測値を補完しなかった。
◎主要評価項目(主解析:検証的解析項目):
投与群を固定効果、ベースラインのUCDAI総スコアを共変量とした共分散分析(ANCOVA)を用いて解析した。両側有意水準は5%とし、閉手順(固定順検定手順)を用いて、下記の通りに解析した。
-
- 【Step 1】
- コレチメント®9mg/日群とpH依存型メサラジン放出調節製剤3600mg/日群の変化量の差の95%信頼区間の上限値が「1.3」を下回った場合に、コレチメント®9mg/日群のpH依存型メサラジン放出調節製剤3600mg/日群に対する「非劣性」が検証されたとした。
- 【Step 2】
- Step 1で「非劣性」が検証された場合、今度は、コレチメント6mg/日群とpH依存型メサラジン放出調節製剤3600mg/日群の変化量の差の95%信頼区間の上限値が「1.3」を下回った場合に、コレチメント6mg/日群のpH依存型メサラジン放出調節製剤3600mg/日群に対する「非劣性」が検証されたとした。
- 【Step 3】
- Step 1およびStep 2でコレチメント®9mg/日群およびコレチメント6mg/日群ともに「非劣性」が検証された場合、今度は、コレチメント®9mg/日群とpH依存型メサラジン放出調節製剤3600mg/日群の変化量の差の95%信頼区間の上限値が「0」を下回る場合に、コレチメント® 9mg/日群のpH依存型メサラジン放出調節製剤3600mg/日群に対する「優越性」が検証されたとした。
- 【Step 4】
- Step 1およびStep 2でコレチメント®9mg/日群およびコレチメント6mg/日群ともに「非劣性」、Step 3でコレチメント®9mg/日群の「優越性」が検証された場合、今度は、コレチメント6mg/日群とpH依存型メサラジン放出調節製剤3600mg/日群の変化量の差の95%信頼区間の上限値が「0」を下回る場合に、コレチメント6mg/日群のpH依存型メサラジン放出調節製剤3600mg/日群に対する「優越性」が検証されたとした。
なお、感度分析として、FAS試験完了例を対象に、欠測値を補完せず主解析と同様の解析を実施した。
また、サブグループ解析として、病変の拡がりによる病型分類別に主要評価項目を評価した。
◎副次評価項目:
投与群および病変の重症度を固定効果とするロジスティック回帰分析モデルを用いて解析した。
- ※1:UCDAI総スコアが1以下で、UCDAIの血便サブスコア・排便回数サブスコア・粘膜所見サブスコアが0
- ※2:ITT解析対象集団(無作為割り付けされた全ての被験者集団)のうち、ベースライン後に少なくとも1回のUCDAIサブスコアが測定されている被験者集団
- ※3:治験薬を少なくとも1回投与された全ての被験者集団
- 【5. 効能又は効果に関連する注意】
- 「17. 臨床成績」の項の内容を熟知し、メサラジン3,600mgを対照とした国内臨床試験で非劣性が検証されていないことを十分に理解した上で、本剤投与の適否を判断すること。[17.1.1、17.1.2 参照]
【6. 用法及び用量】通常、成人にはブデソニドとして9mgを1日1回朝経口投与する。
2024年9月作成
17309-6/N4 B2 MDC