- 医療関係者向けホーム
- 消化器領域
- モビコール®配合内用剤
- Clinical Study:小児国内第Ⅲ相試験 試験の概要
 Clinical Study小児国内第Ⅲ相試験
Clinical Study小児国内第Ⅲ相試験
「モビコール」及びMOVICOLは、Norgineグループの登録商標です。
試験の概要「小児国内第Ⅲ相試験1)」
1)EAファーマ株式会社:社内資料(小児国内第Ⅲ相試験)<承認時評価資料>
当研究は開発会社である味の素製薬株式会社(現、EAファーマ株式会社)の支援にて行われた。
「禁忌を含む使用上の注意」等は添付文書をご参照ください。
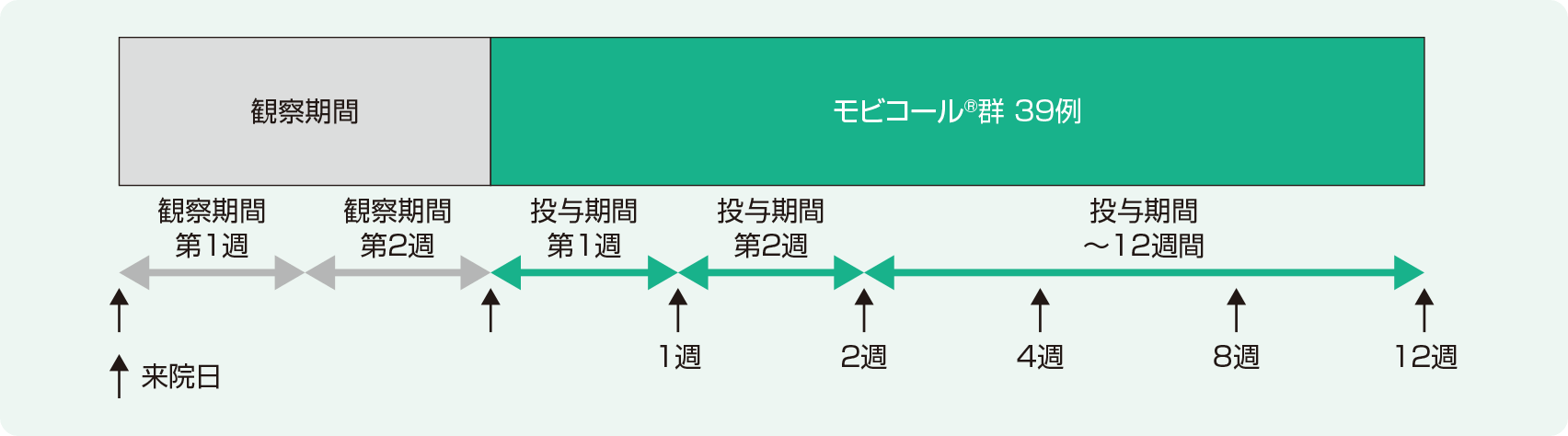
試験デザイン
ベースライン対照非盲検多施設共同試験
目的
小児慢性便秘症患者を対象に、モビコール®を2週間経口投与したときの有効性および安全性について検討する。さらに、12週間投与時の安全性および有効性についても検討する。
対象
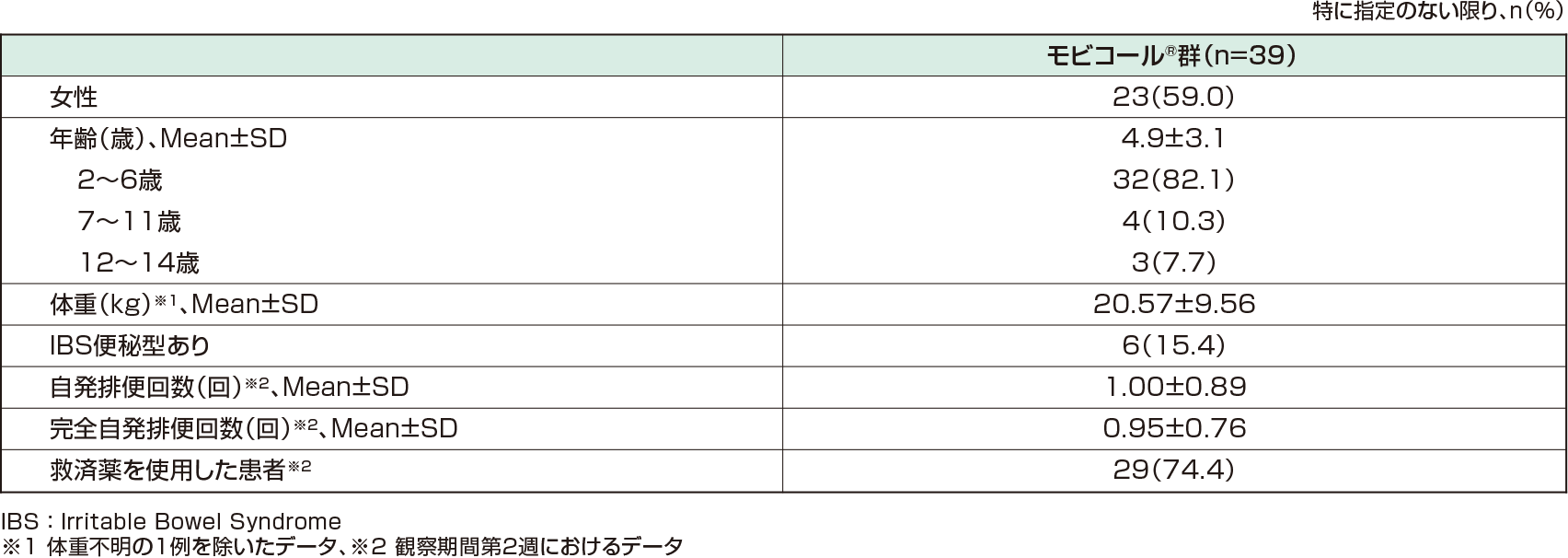
以下の条件を満たす2歳以上14歳以下の慢性便秘症患者39例(有効性解析対象[FAS※1]:39例、安全性解析対象:39例)
- 同意取得時の2ヵ月以上前から自発排便回数が平均2回/週以下
- 同意取得時の2ヵ月以上前から自発排便に関連した以下の①~④の症状を1つ以上有している。
①排便の25%以上にいきみがある。
②排便の25%以上に兎糞状便または硬便がある。
③排便の25%以上に肛門出血がある。
④排便の25%以上に排便時痛がある。 - 2週間の観察期間の自発排便回数が4回以下の患者 等
- ※1FAS:Full Analysis Set(最大の解析対象集団)モビコール®が1回以上投与され、何らかの有効性に関する観測値を持つすべての患者による集団を「最大の解析対象集団」とした。
投与方法
モビコール®6.9g包※2及びプラセボ6.9g包は、1包あたり約62.5mLの水に溶解した。
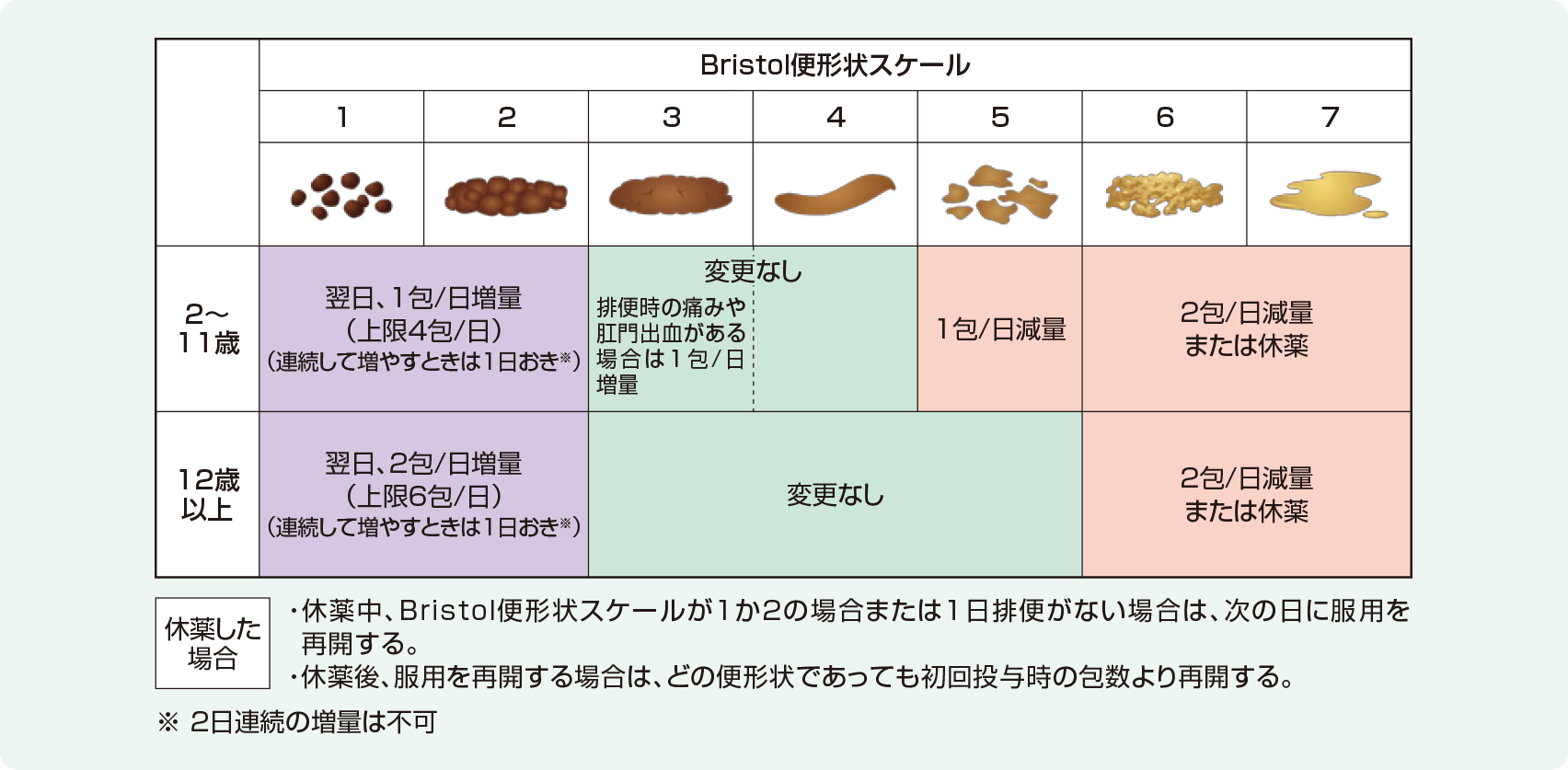
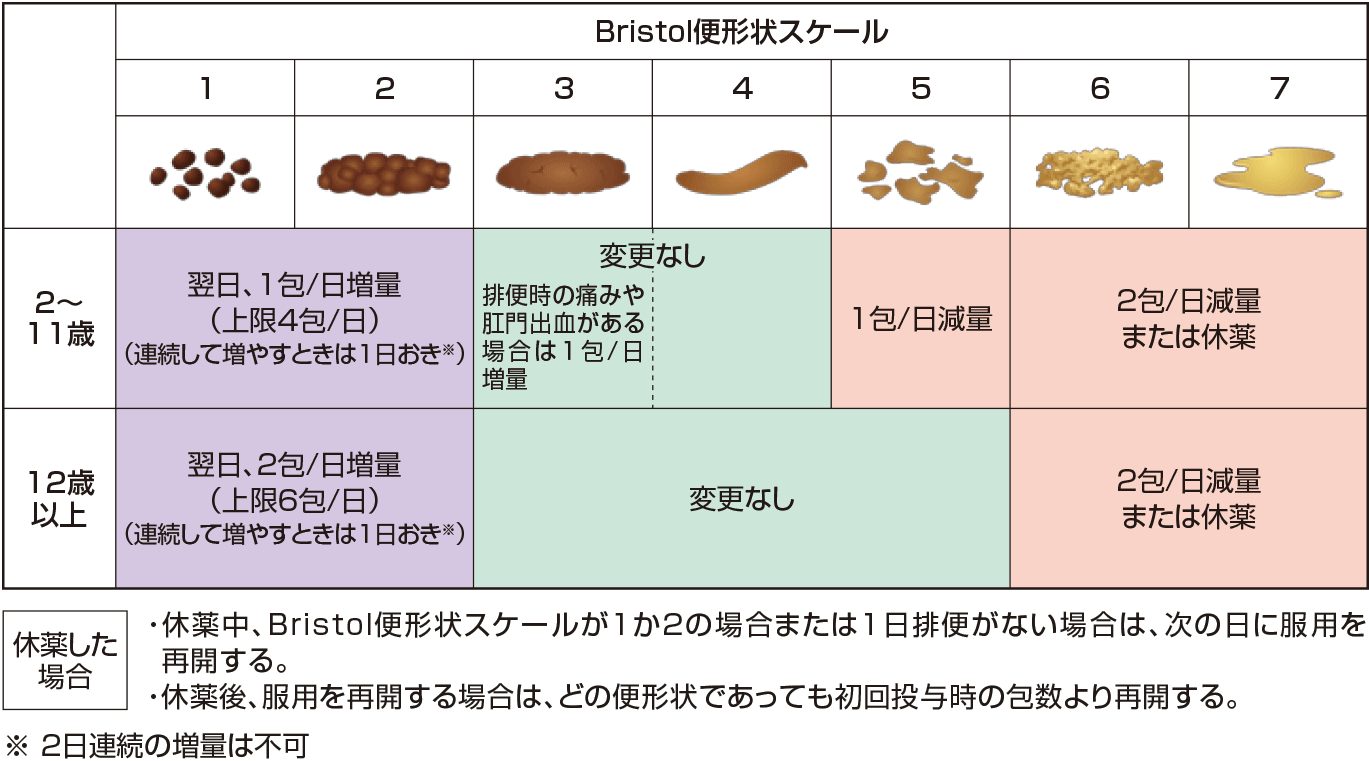
2週間の観察期間の後、モビコール®を12週間経口投与した。開始用量、投与量の上限は以下の表のとおりとし、患者の状態により投与量調節基準を目安に投与量を調整した。なお、増量の場合は1日おきとした。投与のタイミングは、投与量に応じて1日1回または1日2回とし、1日2回の場合は朝、夕に投与した。
仮登録から最終の観察・検査まで、連続して72時間以上排便が認められない場合に限り、ピコスルファートナトリウム、グリセリン浣腸、ビサコジル坐剤のいずれか一つを救済薬として使用することを可とした。また、1剤目の救済薬で排便を認めない場合は、さらに1剤の救済薬の使用を可とした。ただし、モビコール®投与開始日前日および投与開始2日間の救済薬の使用は禁止した。
- ※2モビコール®6.9g包(有効成分:6.8523g):「モビコール®6.9g包」はモビコール®配合内用剤LD 1包(6.8523g)に相当する。
評価項目
有効性に関する評価項目※3
<主要評価項目>
- 投与期間第2週における自発排便回数の観察期間第2週からの変化量
<副次評価項目>
- 投与期間各週の自発排便回数の観察期間第2週からの変化量
- 投与期間各週の完全自発排便回数の観察期間第2週からの変化量
- 投与期間各週の自発排便回数および完全自発排便回数におけるレスポンダーの割合
- 初回自発排便発現までの日数
- 初回完全自発排便発現までの日数
- 救済薬の使用状況
- Bristol便形状スケールに基づいた便硬度
- モビコール®投与包数 等
- ※3有効性評価は患者日誌のデータに基づき行われた。
安全性に関する評価項目
- 有害事象
- 臨床検査
- バイタルサイン
解析計画
主要評価項目の主解析は投与期間第2週の自発排便回数の観察期間第2週からの変化量※4について、自発排便回数の変化量の要約統計量、95%信頼区間を算出し、変化量について対応のあるt-検定(1標本t-検定)を行った。
副次評価項目の投与期間各週の自発排便回数の観察期間第2週からの変化量について変化量の要約統計量、95%信頼区間を算出し、変化量について対応のあるt-検定(1標本t-検定)を行った。投与期間各週の完全自発排便回数の観察期間第2週からの変化量について変化量の要約統計量、95%信頼区間を算出した。初回自発排便発現までの日数および初回完全自発排便発現までの日数は、治験薬投与開始日から、初回自発排便および初回完全自発排便までの日数の要約統計量を算出し、Kaplan-Meier法による中央値およびその95%信頼区間を算出した。Bristol便形状スケールに基づいた便硬度は、便硬度の平均値を連続量として取扱い、要約統計量を算出した。また、評価期間内の便硬度の中央値を算出し、各スコアの頻度表を作成した。更に、便硬度を[1,2]、[3, 4, 5]、[6,7]の3つのカテゴリーに分類した頻度表を作成した。治験薬投与包数は、各被験者における投与包数に関して要約統計量を算出した。なお、モビコール®投与包数については、年齢区分ごとに投与方法が異なるため年齢区分ごとにサブグループ解析を行った。
安全性解析対象集団はモビコール®が1回以上投与された患者とした。
- ※4変化量=観察期間第2週データをベースライン値とした。
用語の定義
| 自発排便 | 下剤/浣腸または摘便なしに発現する排便。本試験においては、救済薬※使用後24時間以内の排便は自発排便としない。 |
|---|---|
| 完全自発排便 | 残便感のない自発排便。 |
| レスポンダー | 1週間あたりの自発排便回数または完全自発排便回数が、観察期間第2週より1回以上改善し、かつ3回以上である患者。 |
- ※小児国内第Ⅲ相試験においては、連続して72時間以上排便が認められない場合に限り、ピコスルファートナトリウム、グリセリン浣腸、ビサコジル坐剤のいずれか一つを救済薬として使用することを可とした。また、1剤目の救済薬で排便を認めない場合は、さらに1剤の救済薬の使用を可とした。
6. 用法及び用量 –一部抜粋-
|
本剤は、水で溶解して経口投与する。 |
8. 重要な基本的注意
|
本剤投与中は腹痛や下痢があらわれるおそれがあるので、症状に応じて減量、休薬又は中止を考慮し、本剤を漫然と継続投与しないよう、定期的に本剤の投与継続の必要性を検討すること。 |