- 医療関係者向けホーム
- 消化器領域
- アダリムマブBS「MA」
- Information:開発の経緯
 Information
Information
開発の経緯
アダリムマブは完全ヒト型抗TNFαモノクローナル抗体で、ヒトTNFαに特異的に結合して細胞表面のTNFα受容体との結合を阻害することによりTNFαの生物活性を中和します1)。加えて、アダリムマブは膜結合型TNFαと結合することで、逆シグナルによるアポトーシスやFc領域を介した抗体依存性細胞傷害(ADCC)活性あるいは補体依存性細胞傷害(CDC)活性を誘導し、TNFα産生細胞を破壊することにより、炎症反応を抑制すると考えられています2,3,4)。
アダリムマブ(遺伝子組換え)[アダリムマブ後続3](以下、本剤)は、チャイニーズハムスター卵巣(CHO)細胞を用いた遺伝子組換え技術により生産した、アダリムマブ(遺伝子組換え)(販売名: ヒュミラ®)(以下、先行バイオ医薬品)のバイオ後続品です。本剤は2012年より、LG Life Sciences社(現LG Chem社、以下、LG Chem社)により開発が開始されました。本邦では、持田製薬株式会社が、2014年にLG Chem社と共同開発契約を締結し、「バイオ後続品の品質・安全性・有効性確保のための指針」(平成21年3月4日付薬食審査発第0304007号)5)に従い、国内の製造販売承認申請に必要な品質試験、非臨床試験及び臨床試験を実施しました。
品質、非臨床及び臨床試験により、本剤と先行バイオ医薬品の同等性/同質性が示されたことから、アダリムマブBS皮下注20mgシリンジ0.2mL「MA」、同40mgシリンジ0.4mL「MA」、同80mgシリンジ0.8mL「MA」、同40mgペン0.4mL「MA」は、再審査期間及び特許を踏まえ、2020年3月に医薬品製造販売承認申請を行い、2021年3月に承認されました。また、2022年2月に既存治療で効果不十分な「非感染性の中間部、後部又は汎ぶどう膜炎」に対する効能又は効果が承認され、2025年3月には「X線基準を満たさない体軸性脊椎関節炎」に対する効能又は効果が承認されました。
承認された効能又は効果は下記の通りです。
〈アダリムマブBS皮下注20mgシリンジ0.2mL「MA」、同40mgシリンジ0.4mL「MA」、同40mgペン0.4mL「MA」〉
既存治療で効果不十分な下記疾患
- 〇多関節に活動性を有する若年性特発性関節炎
〈アダリムマブBS皮下注40mgシリンジ0.4mL「MA」、同ペン0.4mL「MA」〉
既存治療で効果不十分な下記疾患
- 〇X線基準を満たさない体軸性脊椎関節炎
〈アダリムマブBS皮下注40mgシリンジ0.4mL「MA」、同80mgシリンジ0.8mL「MA」、同40mgペン0.4mL「MA」〉
- 〇関節リウマチ(関節の構造的損傷の防止を含む)
-
既存治療で効果不十分な下記疾患
- 〇尋常性乾癬、乾癬性関節炎、膿疱性乾癬
- 〇強直性脊椎炎
- 〇腸管型ベーチェット病
- 〇非感染性の中間部、後部又は汎ぶどう膜炎
- 〇中等症又は重症の活動期にあるクローン病の寛解導入及び維持療法(既存治療で効果不十分な場合に限る)
- 〇中等症又は重症の潰瘍性大腸炎の治療(既存治療で効果不十分な場合に限る)
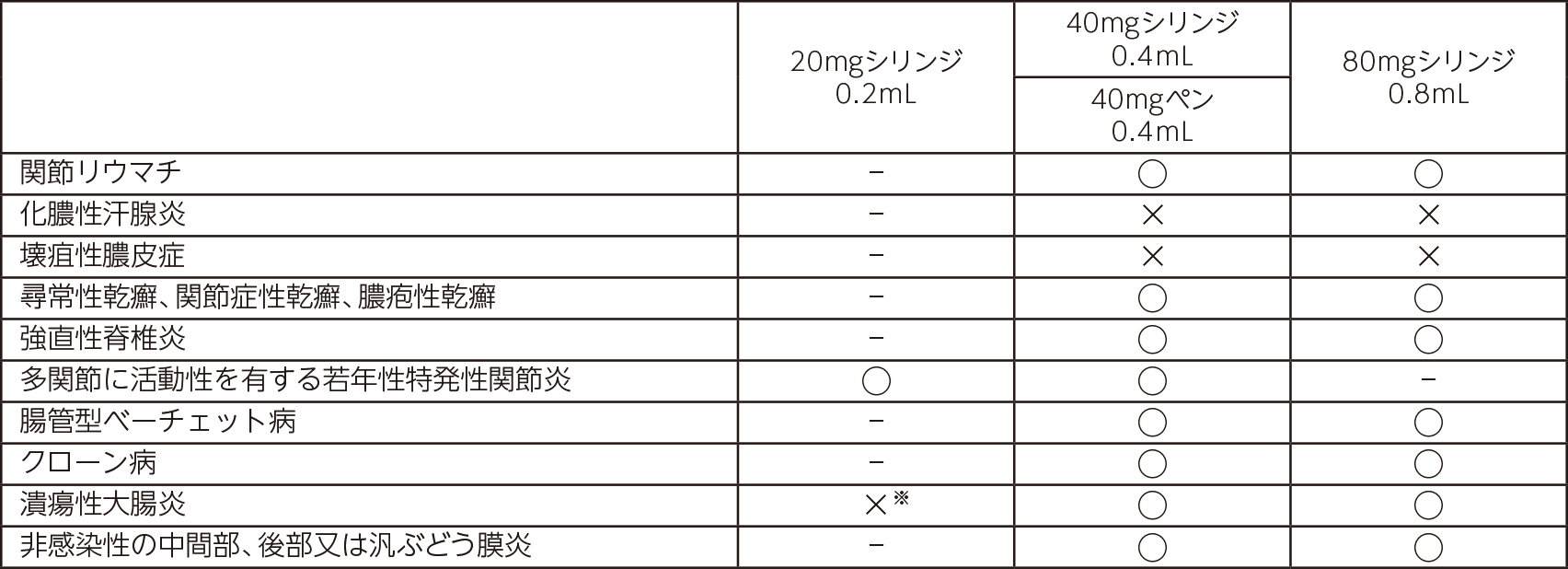
本剤は、先行バイオ医薬品が有する「効能又は効果」の一部(下表)、また、潰瘍性大腸炎の小児に対する用法及び用量は承認を取得しておりません(2025年11月現在)。
- ○は本剤が承認を取得している効能又は効果
- ×は先行バイオ医薬品が有し、本剤が承認を取得していない効能又は効果 ※:先行バイオ医薬品は小児のみ
略語
- TNFα:Tumor Necrosis Factor Alpha(腫瘍壊死因子α)
- ADCC:Antibody-Dependent Cellular Cytotoxicity
- CDC:Complement-Dependent Cytotoxicity
- 1)Zhao S, et al. Curr Rheumatol Rep. 2018;20:57(p.1-10).
- 2)天野宏一. 日本内科学会雑誌. 2011;100:2966
- 3)Tracey D, et al. Pharmacol Ther. 2008;117:244
- 4)Horiuchi T, et al. Rheumatology. 2010;49:1215
- 5)バイオ後続品の品質・安全性・有効性確保のための指針(平成21年3月4日付薬食審査発第0304007号)