Information
Information
バイオシミラーの定義
- バイオシミラーはひと言でいうと、「バイオ医薬品の後続品」という意味です。
- 先行バイオ医薬品と同等/同質の品質、有効性、安全性が確認され、先行バイオ医薬品と「類似の」ものであるとして承認された医薬品です。
- 欧州では、生物を意味する「バイオ」に、「類似の」を意味する「シミラー」を付けて、「バイオシミラー」と呼ばれます。
- わが国では薬事規制上「バイオ後続品」という名称で規定されていますが、「バイオシミラー」という用語も広く使用されていますので、本サイトでは「バイオシミラー」を「バイオ後続品」と同義として表記しています。
バイオシミラーの特徴
臨床試験を行って有効性・安全性が“同等/同質”であることを確認します
- 最終製品としての有効性・安全性に問題がなく、また、先行バイオ医薬品と同等/同質であることを証明するために、臨床試験を行うことが求められています。
独自の製造工程を確立しています
- バイオシミラーの開発にあたって、先行バイオ医薬品の製法に関する情報や生産細胞そのものを入手することは通常困難です。
- そのため、バイオシミラーは独自の製造工程を確立し、先行バイオ医薬品とは異なる培養細胞系や精製方法で製造されます。
安全性の確認のために、製造販売後の調査が行われます
- バイオシミラーは、先行バイオ医薬品と製法が異なることから、培養工程や精製工程に由来する不純物が異なる場合があり、これらが安全性に影響を及ぼす可能性があります。
- 臨床試験によって、先行バイオ医薬品と安全性が同等/同質であると示されても、安全性確認のため、製造販売後に安全性プロファイル等について引き続き調査する必要があると、厚生労働省の通知「薬生薬審発0204第1号 令和2年2月4日『バイオ後続品の品質・安全性・有効性確保のための指針』について」で定められています。
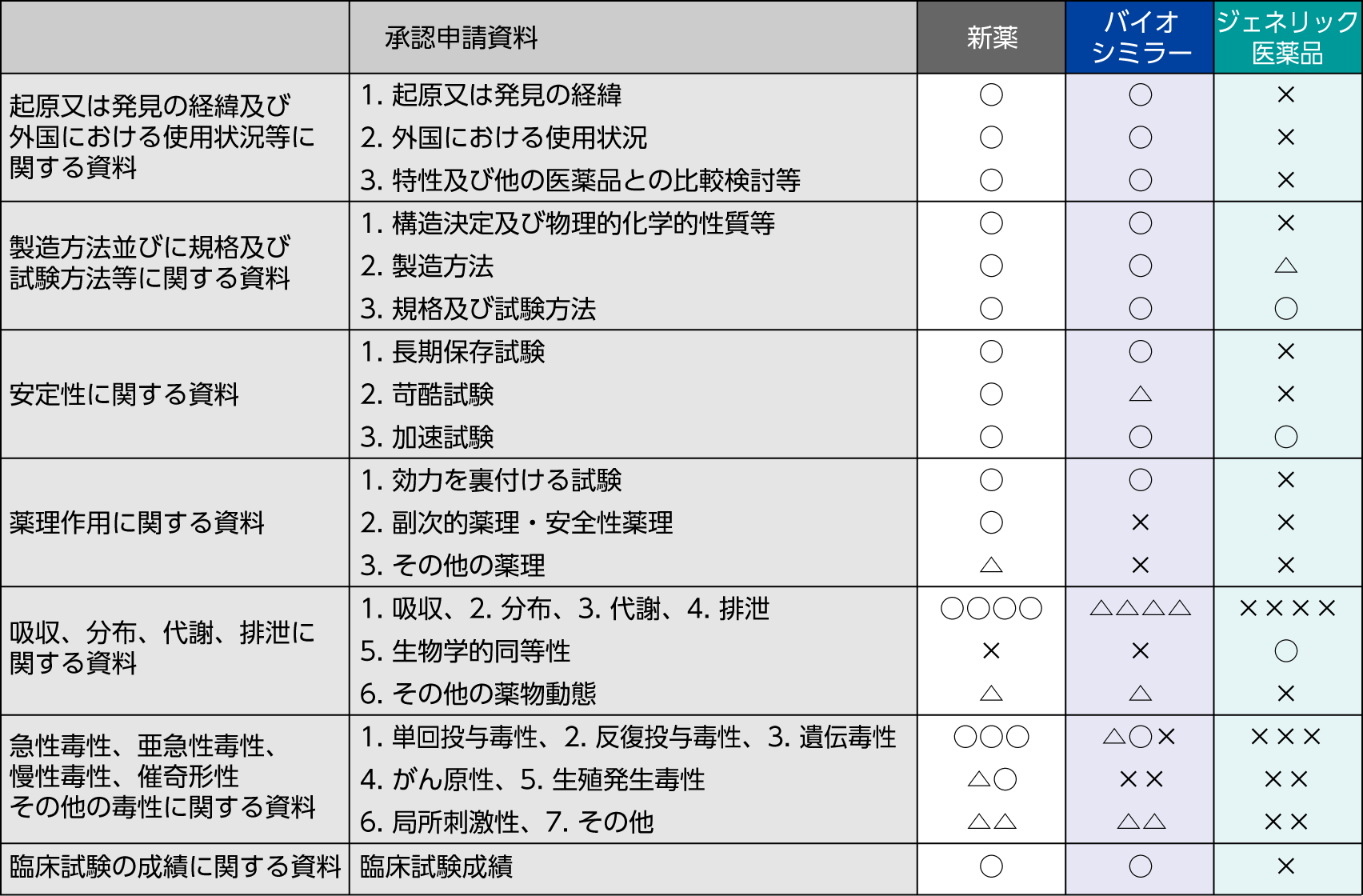
バイオシミラーと後発医薬品(ジェネリック医薬品)の違い
- バイオシミラーは、2009年3月に通知された「バイオ後続品の承認申請について」において、薬事申請上、新薬ともジェネリック医薬品とも異なる新しい区分として分類されています。
- ジェネリック医薬品は、先発医薬品と同一の有効成分を同一量含有していることから、薬物動態が生物学的に同等であれば有効性および安全性も同等であるとみなされます。そのため、ジェネリック医薬品では有効性と安全性を確認するために臨床試験を行う必要はありません。
一方、バイオシミラーは、アミノ酸配列が先行バイオ医薬品と同一でも分子レベルで同一であることを証明することは困難です。そのため、バイオシミラーの承認申請においては、有効性の同等性・同質性を検証し、安全性を確認するために、臨床試験を行うことが求められています。
- ○:添付必要、△:個々に判断、×:添付不要
- 1)製造方法の変更又は試験方法の変更等、添付文書の記載に変更を生じない内容に関する申請に限り、原則として添付は要しない。
- 「薬食発第1121第2号 平成26年11月21日 医薬品の承認申請について」より作成

 Information
Information