- 医療関係者向けホーム
- 皮膚科領域
- ベセルナ
- Clinical Study:国内後期第Ⅱ相試験(日光角化症) 試験の概要
 Clinical Study国内後期第Ⅱ相試験(日光角化症)
Clinical Study国内後期第Ⅱ相試験(日光角化症)
本剤は「日光角化症」に対し、国内で実施された後期第Ⅱ相試験を基に承認されました。国内後期第Ⅱ相試験には一部承認外の成績が含まれますが、用量検討試験として実施されたため掲載します。
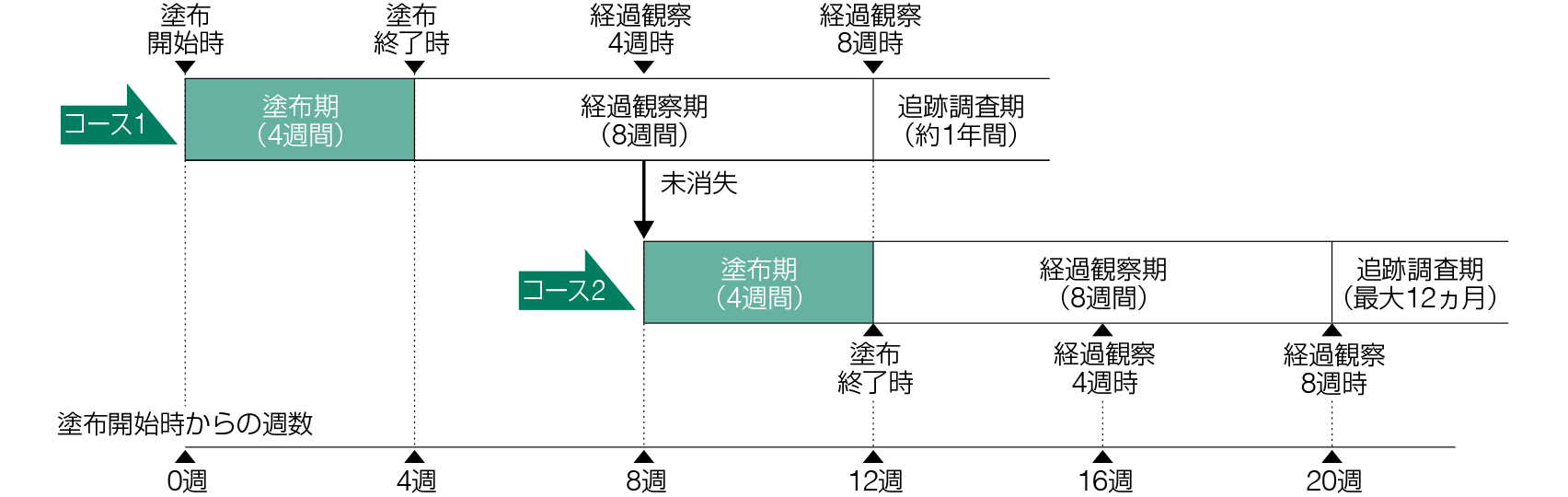
試験の概要「国内後期第Ⅱ相試験(日光角化症)1~4)」
- 1)持田製薬社内資料:国内後期第Ⅱ相週2回または週3回、4週間または8週間塗布試験:MTD3932A21(2011年11月25日承認、CTD2.7.6.4.1)〔承認時評価資料〕
- 2)医薬品医療機器総合機構 ベセルナクリーム5%審査報告書[日光角化症]
- 3)持田製薬社内資料:ベセルナクリーム5% CTD[日光角化症]2.5.4〔承認時評価資料〕
- 4)持田製薬社内資料:ベセルナクリーム5% CTD[日光角化症]2.7.3.1〔承認時評価資料〕
「禁忌を含む注意事項等情報」等は電子添文をご参照ください。
目的
顔面又は禿頭(とくとう)部の日光角化症患者に対するイミキモド5%クリームの週2回注)及び週3回塗布の有効性、安全性を基剤と比較し、用法を検討。また、完全消失例に対して12ヵ月間の追跡調査を実施し、日光角化症病変の再発について調査。
試験デザイン
二重盲検、ランダム化、基剤対照、多施設共同、並行群間比較試験
実施医療機関数
国内34施設
対象
視診及び組織診により日光角化症と診断された20歳以上の男女で、顔面又は禿頭(とくとう)部のいずれか一方の連続する25cm2の部位に1~8個の病変を有する患者(塗布症例数 184例)
| [除外基準] |
|
|---|
試験方法
コース1では、イミキモド5%クリーム又は基剤クリーム1包(250mg)を25cm2の連続した塗布対象部位に、1日1回約8時間(就寝前塗布)、週3回a、4週間塗布した。起床後に石鹸を用い、水あるいは温水でクリームを除去した2)。コース1経過観察4週時に、視診により治験薬の塗布対象部位の病変全てが消失した被験者は治験薬の塗布を終了し、未消失であった被験者はコース2に移行して、コース1と同様に、治験薬を4週間塗布した。コース1又は2の経過観察8週時に病変の完全消失が確認され、かつ再発確認のための追跡調査期の実施に同意した被験者は、追跡調査期(最大12ヵ月)に移行した。
- a:週2回注)群はイミキモド5%クリーム×2回/週、基剤クリーム×1回/週3)
評価項目
[有効性]
主要評価項目は、コース1及びコース2の経過観察8週時(経過観察終了時)における完全消失率とした。
副次評価項目は、病変面積減少率、病変数減少率、再発率とした。
[安全性]
評価項目は、有害事象とした。
解析計画
有効性解析はFull Analysis Set(FAS)とした。主要評価項目は、週3回群、週2回注)群及び基剤群の傾向性については順位スコアを用いたCMH検定にて検証した後、有意差が認められた場合は優越性の検証として、閉検定手順で①~③(①週3回群 vs. 基剤群、②週2回注)群 vs. 基剤群、③週3回群 vs. 週2回注)群)の順に、Fisherの正確検定にて検証した4)。また、コース1終了時のサブグループ解析を行った。副次評価項目は、週3回群及び週2回注)群と基剤群との比較について、病変面積及び病変数の減少率ではWilcoxon 2標本検定、再発率ではFisherの正確検定にて評価した。
- 注)国内で承認されたイミキモドクリーム剤は週3回塗布のみ
患者背景
「塗布対象部位」に3群間で統計学的に有意な不均衡(p=0.032、χ2検定)が認められたが、その他の背景因子では、各群間に偏りは認められなかった。なお、基剤群での「禿頭(とくとう)部」の該当被験者は0例であった。
- a:χ2検定(有意水準:両側15%)の3群比較
- b:ANOVA(有意水準:両側15%)の3群比較
- c:Kruskal-Wallis検定(有意水準:両側15%)の3群比較
ベセルナクリーム5%の〔用法及び用量〕(抜粋)
6. 用法及び用量
- <日光角化症(顔面又は禿頭(とくとう)部に限る)>
治療部位に適量を1日1回、週3回、就寝前に塗布する。塗布後はそのままの状態を保ち、起床後に塗布した薬剤を石鹸を用い、水又は温水で洗い流す。4週間塗布後、4週間休薬し、病変が消失した場合は終了とし、効果不十分の場合はさらに4週間塗布する。