- 医療関係者向けホーム
- 循環器領域
- トレプロスト®吸入液
- Clinical Study(肺動脈性肺高血圧症):海外第Ⅲ相試験 試験の概要
 Clinical Study海外第Ⅲ相試験(肺動脈性肺高血圧症)
Clinical Study海外第Ⅲ相試験(肺動脈性肺高血圧症)
承認外の用法及び用量が含まれますが、承認時評価資料のため紹介します。
試験の概要「海外第Ⅲ相試験1,2)(肺動脈性肺高血圧症)」
- 1)持田製薬社内資料:海外第Ⅲ相試験(トレプロスト吸入液:2022年12月23日承認、CTD 2.7.6.6)<承認時評価資料>
- 2)McLaughlin VV, et al.: J Am Coll Cardiol. 2010; 55(18): 1915-1922[利益相反:本試験はUnited Therapeutics社の支援により実施]
「禁忌を含む注意事項等情報」等は電子添文をご参照ください。
試験デザイン
多施設共同、無作為化、二重盲検、プラセボ対照、並行群間比較試験
目的
PAH患者を対象に、ボセンタン水和物(以下、ボセンタン)又はシルデナフィルクエン酸塩(以下、シルデナフィル)併用下でトレプロスチニルを12週間投与したときの有効性及び安全性を検討した。
対象
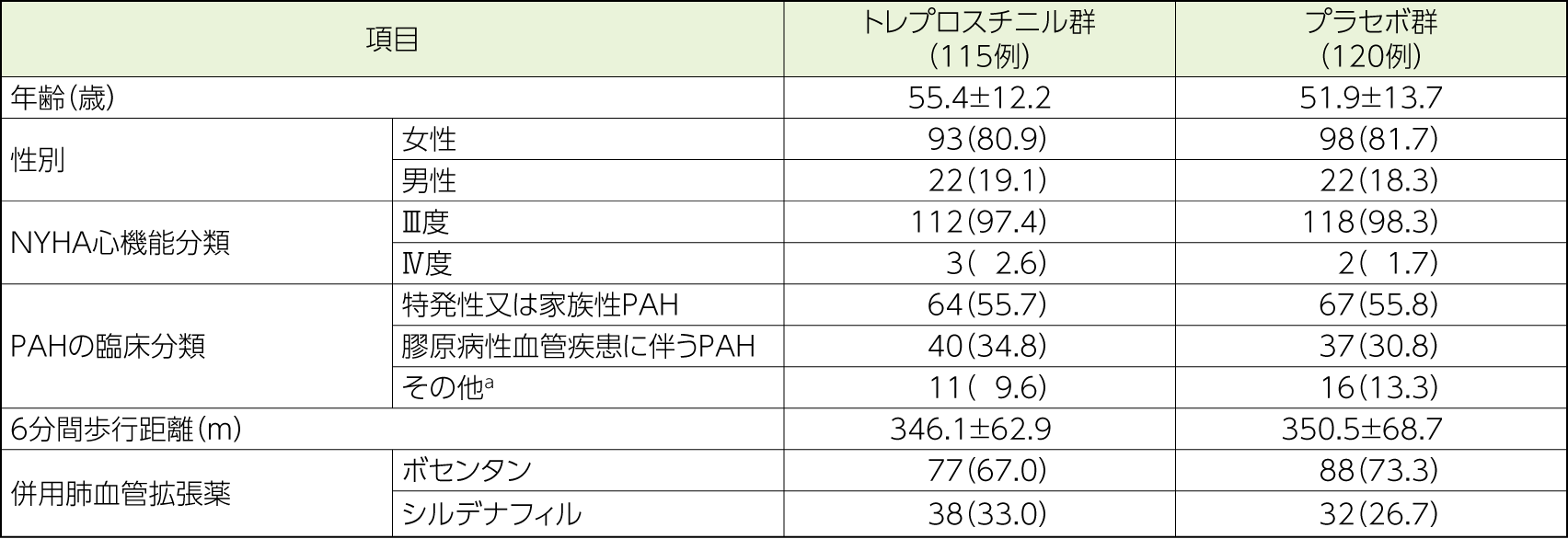
PAH患者235例(トレプロスチニル群:115例 プラセボ群:120例)
- 18歳以上75歳以下の重症PAH患者(性別及び人種は問わない)
- ベースラインにおける6分間歩行距離:200m≦歩行距離≦450m
- ニューヨーク心臓協会(NYHA)心機能分類がⅢ度又はⅣ度の、臨床的に安定した患者
- 右心カテーテル検査の結果:安静時平均肺動脈圧>25mmHg、肺毛細血管楔入圧又は左室拡張末期圧≦15mmHg、肺血管抵抗>3Wood単位(240dyn・sec/cm5)
- 過去3ヵ月以上にわたり、ボセンタン又はシルデナフィルを投与している患者
投与方法
トレプロスチニル又はプラセボを1日4回、1回1~9吸入(6~54μg)、Optinebネブライザを用いて12週間吸入投与した。1回の吸入量は3吸入(18μg)から開始し、患者の忍容性に問題があると判断した場合は1回量を1吸入(6μg)又は2吸入(12μg)に減量した。患者の忍容性に問題がないと判断した場合は、1回量として1吸入(6μg)、2吸入(12μg)又は3吸入(18μg)ずつ漸増し、最大9吸入(54μg)まで増量した。
ボセンタン又はシルデナフィルを併用薬として、試験参加前と同じ用法・用量で経口投与した。
解析計画
有効性の評価
- 主要評価項目:12週時におけるピーク時6分間歩行距離のベースラインからの変化量について、両群間の差の中央値をHodges-Lehmann法により推定し、ベースラインの6分間歩行距離及びPAHの臨床分類を共変量としたノンパラメトリックANCOVAにて解析した。
- 副次評価項目:6分間歩行距離は主要評価項目と同様に解析した。Borg呼吸困難スコア、MLWHF、NYHA心機能分類及びPAHの徴候・症状における群間比較にはWilcoxon順位和検定を用いた。
以下に定義する臨床症状悪化までの時間に基づきKaplan-Meierプロットを作成し、イベント発現割合を算出し、群間比較にはlog-rank検定を用いた。- 死亡
- 肺移植
- 承認済みPAH治療薬の新たな追加
- PAHの悪化による入院(待機的手術、事故、及び薬剤に関連した有害事象のための入院は含まない)
- 欠測値の補完:
- a:ベースライン以外の測定値がない場合はBOCF
初回投与時におけるピーク時6分間歩行距離及びPAHの徴候・症状(項目別)は、欠測値を補完しなかった。
- a:ベースライン以外の測定値がない場合はBOCF
- 安全性の評価:安全性解析対象集団は、トレプロスチニル又はプラセボを1度でも投与された患者を含む集団とした。
曝露状況
- 例数(%)
- a:海外第Ⅲ相試験で規定した1回最大投与量は9吸入であり、治験実施計画書からの逸脱に該当
- 例数(%)
- a:海外第Ⅲ相試験で規定した1回最大投与量は9吸入であり、治験実施計画書からの逸脱に該当
5. 効能又は効果に関連する注意(抜粋)
〈肺動脈性肺高血圧症〉
- 5.3 特発性肺動脈性肺高血圧症、遺伝性肺動脈性肺高血圧症及び結合組織病に伴う肺動脈性肺高血圧症以外の肺動脈性肺高血圧症における有効性及び安全性は確立していない。
6. 用法及び用量(抜粋)
〈肺動脈性肺高血圧症〉
通常、成人には、1日4回ネブライザを用いて吸入投与する。1回3吸入(トレプロスチニルとして18μg)から投与を開始し、忍容性を確認しながら、7日以上の間隔で、1回3吸入ずつ、最大9吸入(トレプロスチニルとして54μg)まで漸増する。3吸入の増量に対して忍容性に懸念がある場合は、増量幅を1又は2吸入としてもよい。忍容性がない場合は減量し、1回最小量は1吸入とすること。
7. 用法及び用量に関連する注意(抜粋)
- 7.2 本剤の吸入にはTD-300/Jネブライザを使用すること。[14.1 参照]
2025年11月作成
17050-14/N6 60 GMJ