- 医療関係者向けホーム
- 循環器領域
- トレプロスト®吸入液
- Clinical Study(間質性肺疾患に伴う肺高血圧症):海外第Ⅲ相継続試験 試験の概要
 Clinical Study海外第Ⅱ/Ⅲ相継続試験(間質性肺疾患に伴う肺高血圧症)
Clinical Study海外第Ⅱ/Ⅲ相継続試験(間質性肺疾患に伴う肺高血圧症)
承認外の用法及び用量が含まれますが、承認時評価資料のため紹介します。
試験の概要「海外第Ⅱ/Ⅲ相継続試験1,2)(間質性肺疾患に伴う肺高血圧症)」
- 1)持田製薬社内資料:海外第Ⅱ/Ⅲ相継続試験(トレプロスト吸入液、CTD 2.7.6.3)<承認時評価資料>
- 2)Waxman A, et al.: Eur Respir J. 2023; 61(6): 2202414[利益相反:本試験はUnited Therapeutics社の支援により実施]
「禁忌を含む注意事項等情報」等は電子添文をご参照ください。
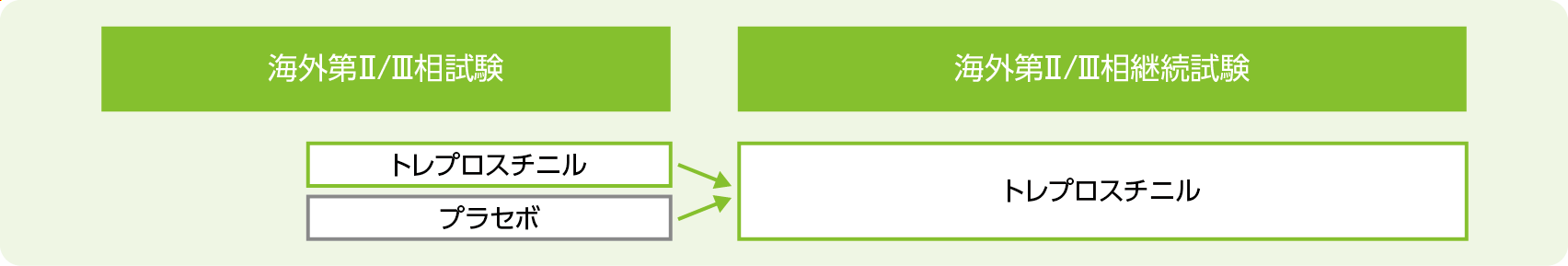
試験デザイン
多施設共同、非盲検、非対照試験
目的
海外第Ⅱ/Ⅲ相試験に参加した患者に対してトレプロスチニルを継続して提供することを主要な目的とし、ILD-PH患者におけるトレプロスチニル長期投与時の有効性及び安全性を検討した。
対象
ILD-PH患者242例(海外第Ⅱ/Ⅲ相試験でトレプロスチニル群だった集団:119例 海外第Ⅱ/Ⅲ相試験でプラセボ群だった集団:121例)
海外第Ⅱ/Ⅲ相試験を完了したもしくは臨床症状悪化を理由に治験薬を投与中止したものの必要なすべての来院を完了した患者
投与方法
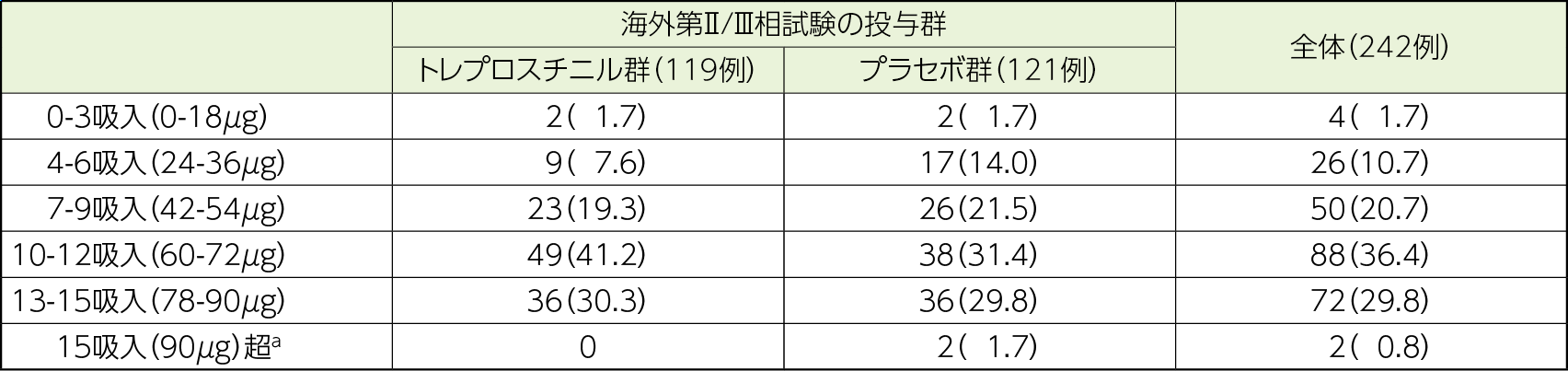
トレプロスチニルを1日4回、1回1~15吸入(6μg~90μg)、TD-100ネブライザを用いて108週間吸入投与した。1回の吸入量は海外第Ⅱ/Ⅲ相試験での投与群によらず3吸入(18μg)から開始し、患者の忍容性に問題があると判断した場合は1回の吸入量を1吸入(6μg)又は2吸入(12μg)に減量した。患者の忍容性に問題がないと判断した場合は、1回1吸入(6μg)ずつ漸増した。
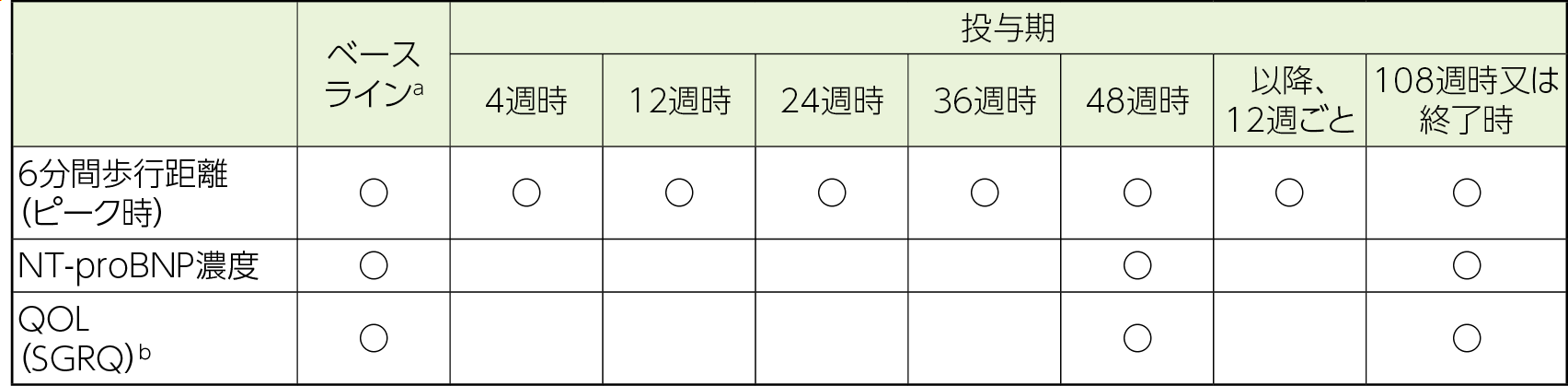
評価項目
- a:海外第Ⅱ/Ⅲ相試験の16週時もしくは中止時として実施した結果又は海外第Ⅱ/Ⅲ相継続試験の治験薬投与開始までに実施した結果
- b:喘息及び慢性閉塞性肺疾患向けの疾患特異的な健康関連QOLだが、間質性肺疾患患者を対象とした肺機能、6分間歩行距離及び呼吸困難の重症度等と相関が見られたことも報告されている3)
- 安全性評価項目
有害事象(副作用)、呼吸機能検査、他
- 3)Chang JA, et al.: Chest. 1999; 116(5): 1175-1182
解析計画
解析対象集団は安全性解析対象集団とし、治験薬を投与された242例(海外第Ⅱ/Ⅲ相試験でトレプロスチニル群だった集団:119例、海外第Ⅱ/Ⅲ相試験でプラセボ群だった集団:121例)であった。
SGRQのベースライン(海外第Ⅱ/Ⅲ相試験の16週時もしくは中止時として実施した結果又は海外第Ⅱ/Ⅲ相継続試験の治験薬投与開始までに実施した結果)からの変化量の要約統計量について、海外第Ⅱ/Ⅲ相試験での投与群別に算出した。6分間歩行距離及びNT-proBNP濃度については、海外第Ⅱ/Ⅲ相試験のベースラインからの変化量の要約統計量を海外第Ⅱ/Ⅲ相試験での投与群別に算出した。
有害事象の集計は、本試験における治験薬投与開始以降に発現した有害事象を対象とした。呼吸機能検査について、要約統計量を算出した。
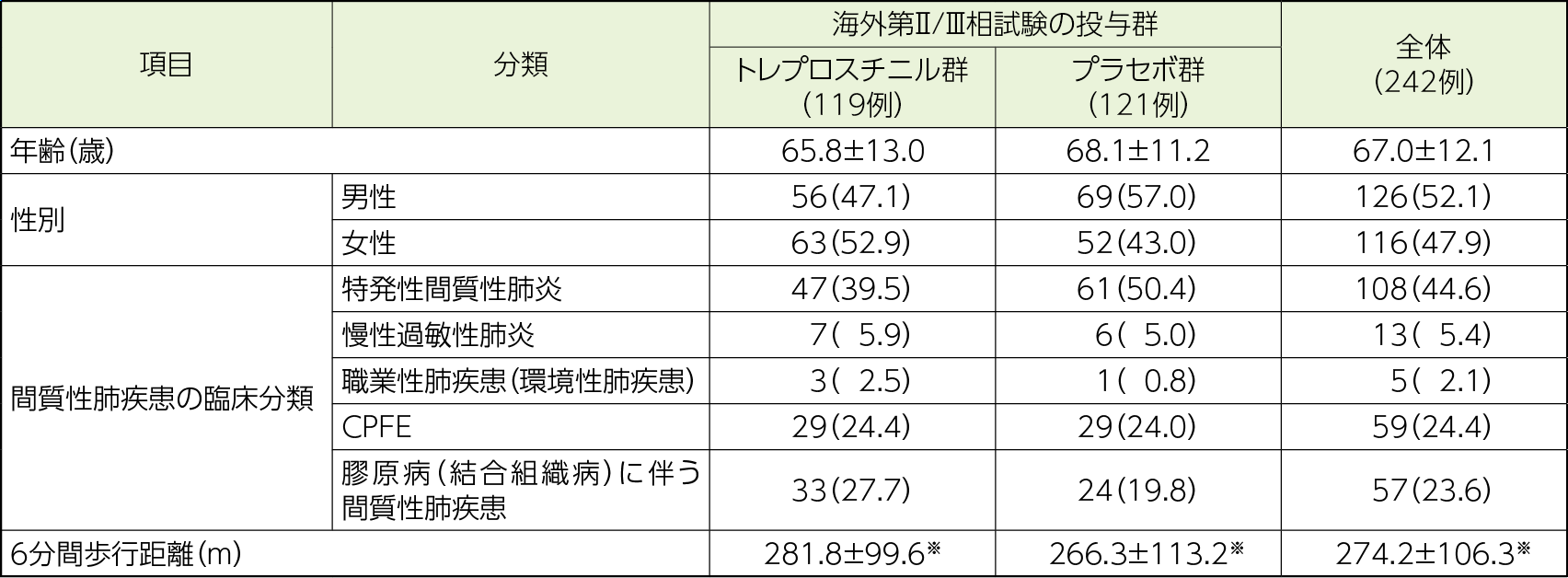
患者背景
- 例数(%)又は平均値±標準偏差
- ※6分間歩行距離のベースラインを測定した例数は、トレプロスチニル群が114例、プラセボ群が113例、全体が229例
6. 用法及び用量(抜粋)
〈間質性肺疾患に伴う肺高血圧症〉
通常、成人には、1日4回ネブライザを用いて吸入投与する。1回3吸入(トレプロスチニルとして18μg)から投与を開始し、忍容性を確認しながら、3日以上の間隔で、1回1吸入ずつ、最大12吸入(トレプロスチニルとして72μg)まで漸増する。忍容性がない場合は減量し、1回最小量は1吸入とすること。
7. 用法及び用量に関連する注意(抜粋)
- 7.2 本剤の吸入にはTD-300/Jネブライザを使用すること。[14.1 参照]
2025年11月作成
17050-14/N6 60 GMJ