- 医療関係者向けホーム
- 循環器領域
- トレプロスト®吸入液
- Clinical Study(間質性肺疾患に伴う肺高血圧症):国内第Ⅱ/Ⅲ相試験 試験の概要
 Clinical Study国内第Ⅱ/Ⅲ相試験(間質性肺疾患に伴う肺高血圧症)
Clinical Study国内第Ⅱ/Ⅲ相試験(間質性肺疾患に伴う肺高血圧症)
試験の概要「国内第Ⅱ/Ⅲ相試験1)(間質性肺疾患に伴う肺高血圧症)」
- 1)持田製薬社内資料:国内第Ⅱ/Ⅲ相試験(トレプロスト吸入液、CTD 2.7.6.2)<承認時評価資料>
「禁忌を含む注意事項等情報」等は電子添文をご参照ください。
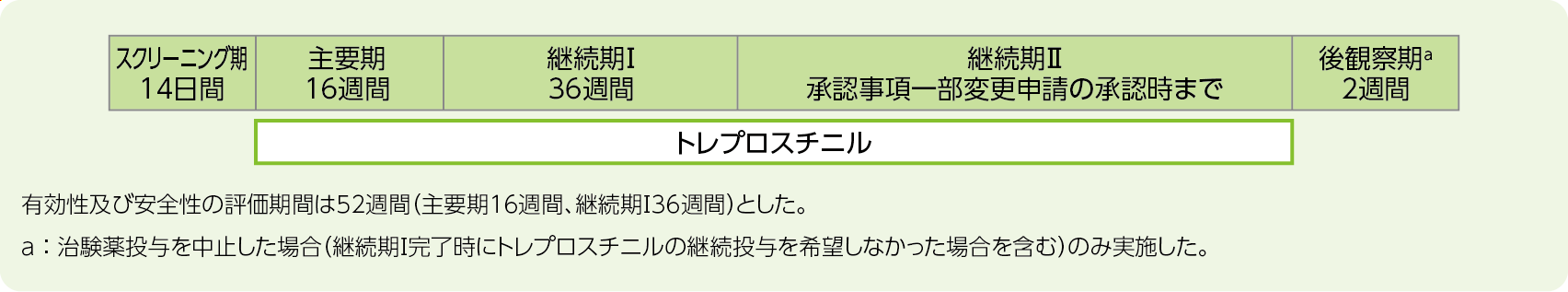
試験デザイン
多施設共同、非盲検、非対照試験
目的
ILD-PH(CPFEを含む)患者においてトレプロスチニルを16週間投与したときの有効性、トレプロスチニルを52週間投与したときの安全性、及びトレプロスチニルを投与したときの薬物動態を検討した。
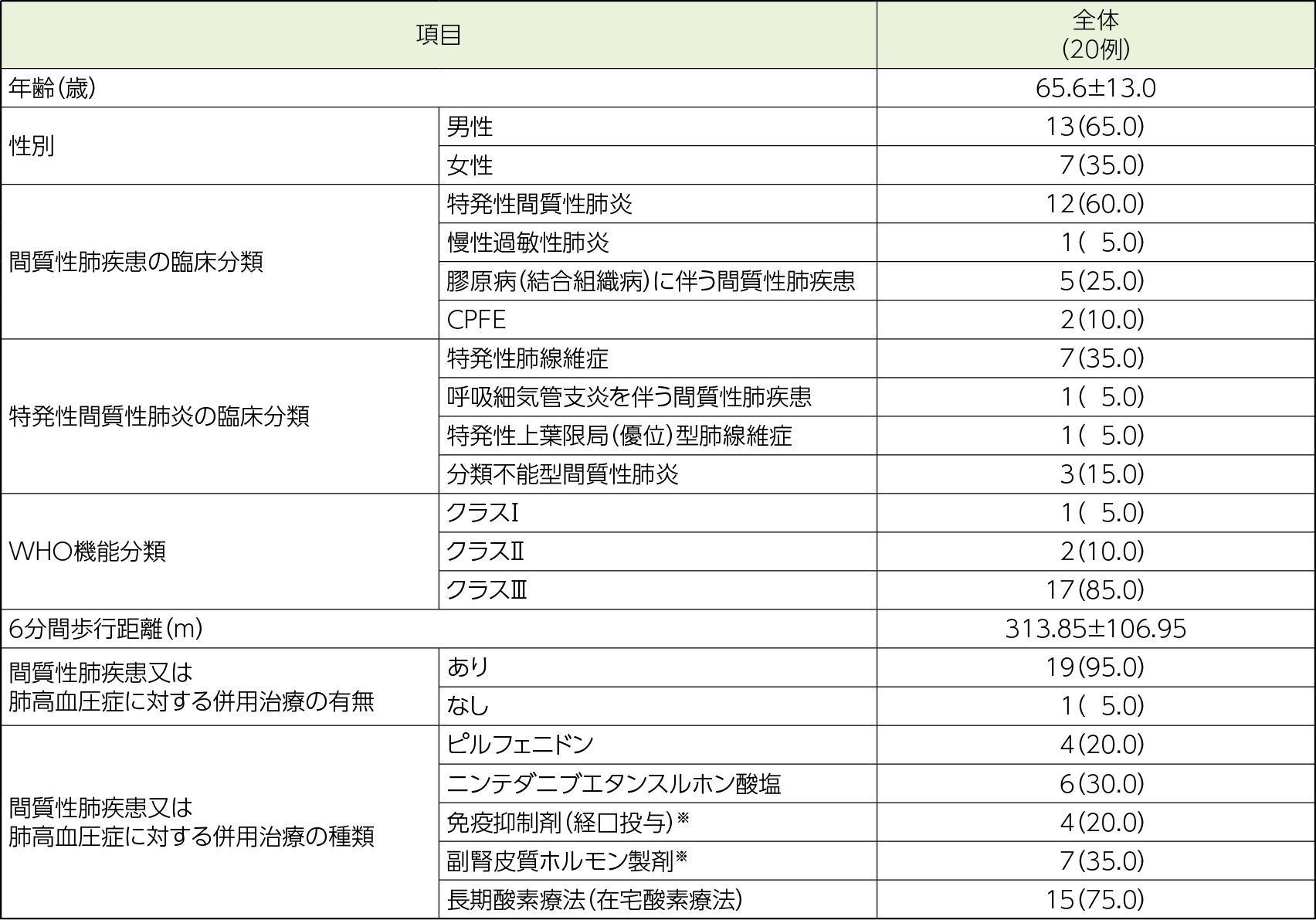
対象
ILD-PH患者20例
- 再改訂版肺高血圧症臨床分類第3群のうち、間質性肺疾患又はCPFEに伴う肺高血圧症患者
- 18歳以上80歳以下の男女
- 右心カテーテル検査の結果:安静時平均肺動脈圧≧25mmHg、肺動脈楔入圧≦15mmHg、肺血管抵抗>3Wood単位(240dyn・sec/cm5)
- 6分間歩行距離≧100m
- ベースラインにおける右心カテーテル検査により測定した安静時のPVRと、ベースラインの右心カテーテル検査実施日から起算して過去14日以上かつ過去60日間以内に実施した右心カテーテル検査により測定した安静時のPVRを比較し、変動が±20%未満かつ±3Wood単位未満であり肺高血圧症の病態が安定していると医師が判断した患者。当該期間に右心カテーテル検査を実施していない場合、ベースラインに心臓超音波検査を実施し測定した三尖弁圧較差(以下、TRPG)と、ベースラインの心臓超音波検査実施日から起算して過去14日以上かつ過去60日間以内に実施した心臓超音波検査により測定したTRPGを比較し、変動が±20%未満かつ±15mmHg未満であり肺高血圧症の病態が安定していると医師が判断した患者
- ベースラインにおける胸部X線検査の所見と、ベースラインの胸部X線検査実施日から起算して過去30日以上前に実施した胸部X線検査の所見を比較し、両側性すりガラス影及び浸潤影の程度に著変がなく、間質性肺疾患(CPFEを含む)の病態が改善傾向又は悪化傾向にないと医師が判断した患者
投与方法
トレプロスチニルを1日4回、1回1~12吸入(6~72μg)、52週間(患者が継続投与を希望する場合、トレプロスト吸入液の承認事項一部変更申請の承認時まで)TD-300/Jネブライザを用いて吸入投与した。吸入間隔は約4時間とした。1回の吸入量は3吸入(18μg)から開始し、忍容性を確認しながら3日間以上各用量を投与した上で、1回1吸入(6μg)ずつ漸増した。また、忍容性に問題があると判断した場合は1回の吸入量を減量することを可能とした。
以下の併用を許容した。
- ピルフェニドン、ニンテダニブエタンスルホン酸塩、免疫抑制剤(経口)※:新規開始、中止又は用法及び用量を変更しないこと
- 副腎皮質ホルモン製剤(経口、静脈内、関節内、硬膜外)※:プレドニゾロン1日20mg相当を超えない量であること
- 呼吸リハビリテーション:新規開始しないこと
- 長期酸素療法(在宅酸素療法):10L/minを超えていないこと
- ※間質性肺疾患又は間質性肺疾患に伴う肺高血圧症の効能又は効果を有さないものを含む。
略語一覧
- PVRI:肺血管抵抗係数
- PVR:肺血管抵抗
- mean PAP:平均肺動脈圧
- diastolic PAP:肺動脈拡張期圧
- systolic PAP:肺動脈収縮期圧
- CO:心拍出量
- CI:心係数
- SVR:体血管抵抗
- SVRI:体血管抵抗係数
- mean RAP:平均右心房圧
- PAWP:肺動脈楔入圧
- SvO2:混合静脈血酸素飽和度
- NT-proBNP:ヒト脳性ナトリウム利尿ペプチド前駆体N端フラグメント
- SGRQ:St. George’s Respiratory Questionnaire
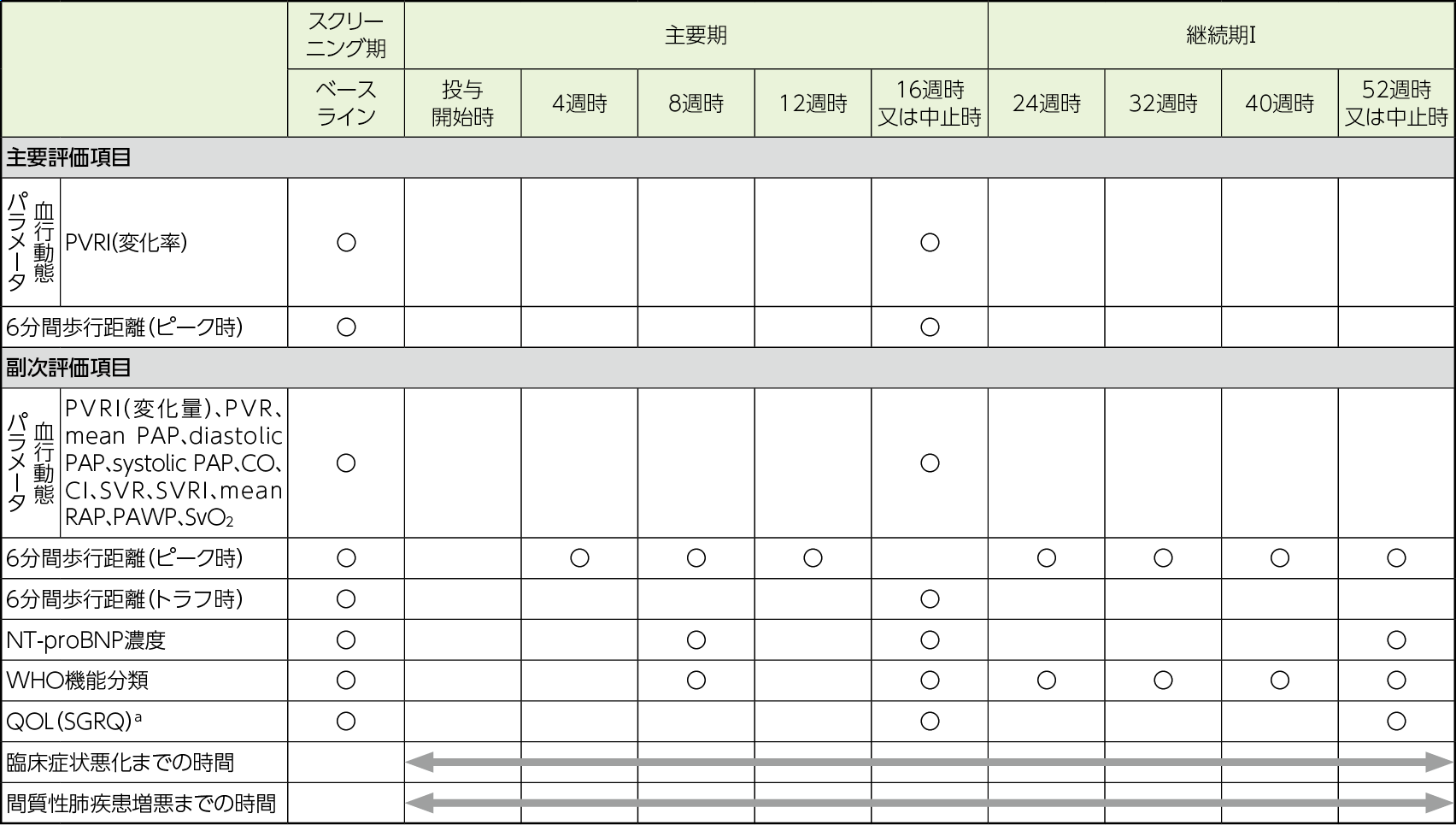
評価項目
- a:喘息及び慢性閉塞性肺疾患向けの疾患特異的な健康関連QOLだが、間質性肺疾患患者を対象とした肺機能、6分間歩行距離及び呼吸困難の重症度等と相関が見られたことも報告されている2)
- 安全性評価項目
有害事象(副作用)、呼吸機能検査、他
- 2)Chang JA, et al.: Chest. 1999; 116(5): 1175-1182
解析計画
有効性の評価:
有効性の解析対象集団はFASとした。
主要評価項目:
- (1)
- (2)
副次評価項目:
要約統計量及び平均値又は中央値の両側95%信頼区間を算出した。
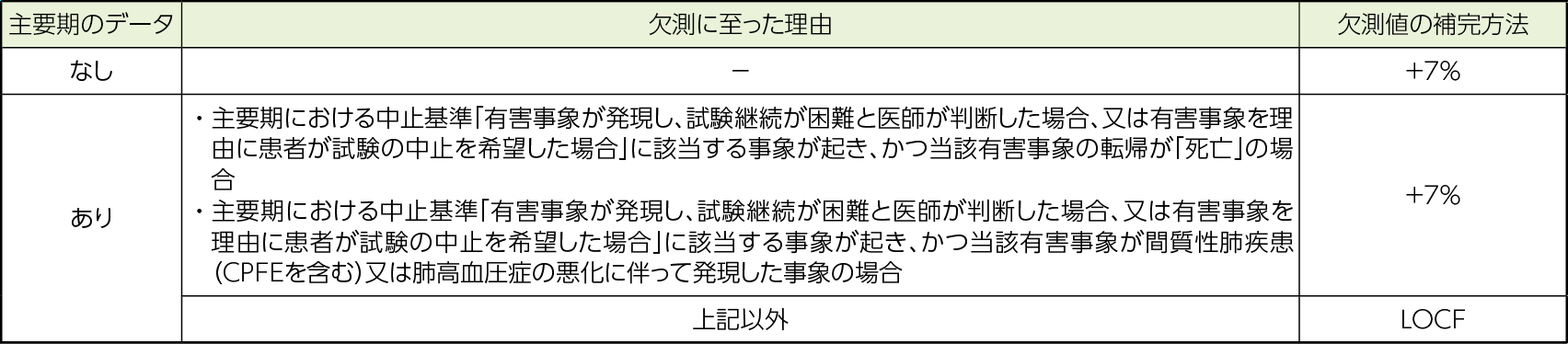
血行動態パラメータのうち、PVRI、PVR、mean PAP、SVR、SVRI、mean RAP、PAWP、diastolic PAP及びsystolic PAPについては、16週時における治験薬投与後15分又は30分の測定値又は算出値のうち、より低い値を最良値として評価に用いた。また、データが欠測した場合、主要評価項目としてのPVRIと同様の方法で補完を行った。CO、CI及びSvO2については、16週時における治験薬投与後15分又は30分の測定値又は算出値のうち、より高い値を最良値として評価に用いた。また、データが欠測した場合、表の「+7%」を「−7%」と読み替えた上で主要評価項目におけるPVRIと同様の方法で補完を行った。
6分間歩行距離のうち、8週時(ピーク時)、12週時(ピーク時)及び16週時(トラフ時)についてはデータが欠測した場合、主要評価項目としての6分間歩行距離と同様の方法で補完を行った。52週時(ピーク時)についてはLOCF(代入可能なデータがない場合、BOCF)及び補完なしとし、その他の評価時期は補完なしとした。
NT-proBNP濃度についてはデータが欠測した場合、16週時及び52週時はLOCFで補完し、その他の評価時期は補完なしとした。
SGRQについてはデータが欠測した場合、16週時及び52週時はLOCFで補完し、その他の評価時期は補完なしとした。
SGRQについては、ベースラインから「4」以上改善(低下)した患者の割合の算出も行った。
WHO機能分類については各評価時期の測定値を用いた。データが欠測した場合、16週時及び52週時はLOCFで補完し、その他の評価時期は補完なしとした。
臨床症状悪化までの時間及び間質性肺疾患増悪までの時間については、Kaplan-Meier推定を行った。また、イベント発現率及びその両側95%信頼区間を算出した。なお、臨床症状悪化のイベントは以下の通り定義した。
- 死亡(原因は問わない)
- 心肺症状悪化のための入院
- 肺移植
- 間質性肺疾患又は肺高血圧症の悪化に伴い、6分間歩行距離が2回連続でベースラインから15%を超えて短縮した場合
安全性の評価:
安全性解析対象集団は、主要期に治験薬を投与され、安全性評価に関するデータがある患者とした。安全性解析対象集団はFASと同一であった。呼吸機能検査について、要約統計量を算出した。
2025年11月作成
17050-14/N6 60 GMJ