- 医療関係者向けホーム
- 循環器領域
- トレプロスト®注射液
- Clinical Study:海外第Ⅲ相試験の2試験(プラセボ対照皮下投与試験)併合解析(海外データ) 安全性
 Clinical Study海外第Ⅲ相試験の2試験(プラセボ対照皮下投与試験)併合解析
Clinical Study海外第Ⅲ相試験の2試験(プラセボ対照皮下投与試験)併合解析
(海外データ)
安全性
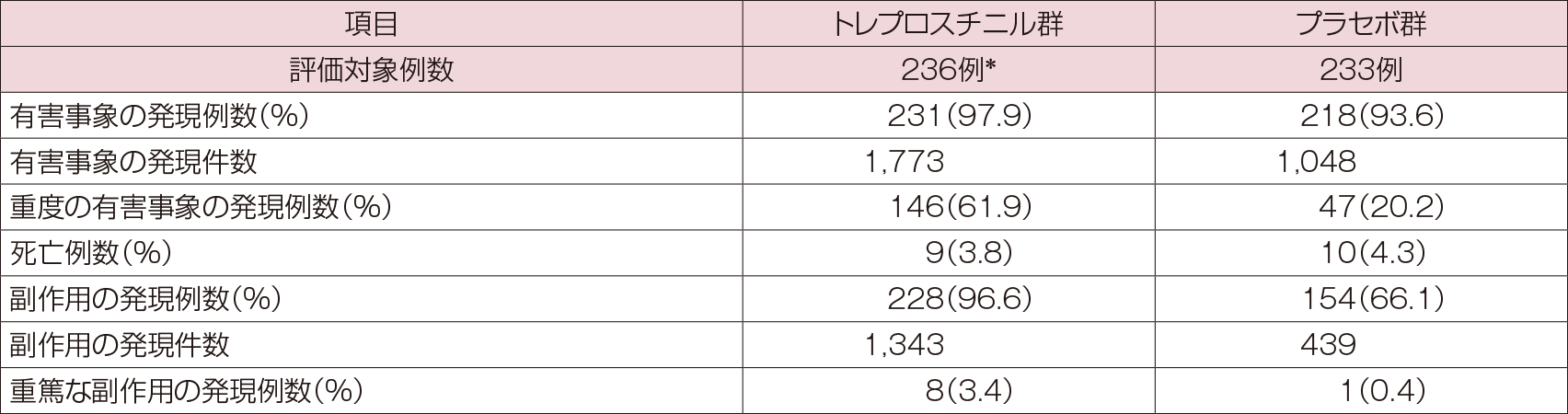
トレプロスチニル群における有害事象は、97.9%(231/236例、1,773件)、副作用は、96.6%(228/236例、1,343件)に認められた。主な副作用は、注入部位疼痛84.7%(200/236例)、注入部位反応83.1%(196例)、頭痛23.3%(55例)、下痢21.6%(51例)、注入部位出血/挫傷21.2%(50例)、悪心18.6%(44例)、顎痛12.7%(30例)、発疹11.4%(27例)、疼痛9.7%(23例)、血管拡張9.7%(23例)、浮腫7.6%(18例)、瘙痒症6.8%(16例)であった。トレプロスチニル群の重篤な副作用は3.4%(8/236例)に認められ、嘔吐0.8%(2例)、注入部位疼痛、注入部位反応、頭痛、疼痛、頸部痛、脱水、下痢、出血性胃炎、メレナ、溶血性貧血、心不全0.4%(各1例)であった。トレプロスチニル群の心不全を発現した1例に因果関係が否定できない死亡例が認められた。
プラセボ群における有害事象は、93.6%(218/233例、1,048件)、副作用は、66.1%(154/233例、439件)に認められた。主な副作用は、注入部位疼痛24.9%(58/233例)、注入部位反応21.9%(51例)、注入部位出血/挫傷21.5%(50例)、頭痛11.6%(27例)、悪心10.7%(25例)、下痢9.9%(23例)、斑状出血6.4%(15例)、疼痛6.0%(14例)であった。プラセボ群の重篤な副作用は0.4%(1/233例)にうっ血性心不全が認められた。
有害事象による中止は、トレプロスチニル群およびプラセボ群で、それぞれ7.6%(18/236例)および0.4%(1/233例)に認められ、トレプロスチニル群はいずれも副作用と判断された。トレプロスチニル群における中止に至った有害事象は、注入部位疼痛7.2%(17例)、注入部位反応3.0%(7例)、注入部位出血/挫傷0.8%(2例)、不安0.4%(1例)であった。
- *プラセボ群にもかかわらず、誤ってトレプロスチニルが投与された3例を含む。
- 本試験の副作用の詳細はこちらをご参照ください。