- 医療関係者向けホーム
- 循環器領域
- トレプロスト®注射液
- Clinical Study:国内第Ⅱ/Ⅲ相追加試験(静脈内投与試験) 試験の概要
 Clinical Study国内第Ⅱ/Ⅲ相追加試験(静脈内投与試験)
Clinical Study国内第Ⅱ/Ⅲ相追加試験(静脈内投与試験)
試験の概要「国内第Ⅱ/Ⅲ相追加試験(静脈内投与試験;MD070123P22試験)1,2)」
- 1)持田製薬社内資料:国内患者対象追加試験(2014年3月24日承認、CTD 2.7.6.7.2)<承認時評価資料>
- 2)大森庸子ほか:Prog Med 34, 333-348(2014)
[利益相反:共同執筆者(京谷晋吾)は、トレプロスチニルのPAHの治験の医学専門家を務めた。
また、著者に持田製薬株式会社の社員が含まれている。本論文の作成、出版に関する費用は持田製薬株式会社が負担した。]
「警告、禁忌を含む使用上の注意」等は電子添文をご参照ください。
試験デザイン
多施設共同、非盲検、非ランダム化、非対照試験
目的
トレプロスチニルの持続静脈内投与における有効性、安全性及び薬物動態を検討した。
対象
16~64歳の特発性/家族性又は膠原病性血管疾患に伴う肺動脈性肺高血圧症患者(PAH)5例
- WHO機能分類クラスⅡ~Ⅳ
- 6分間歩行距離:50m≦歩行距離≦450m
- 右心カテーテル検査:安静時平均肺動脈圧>25mmHg、肺毛細血管楔入圧<15mmHg、肺血管抵抗>3mmHg・分/L
投与方法
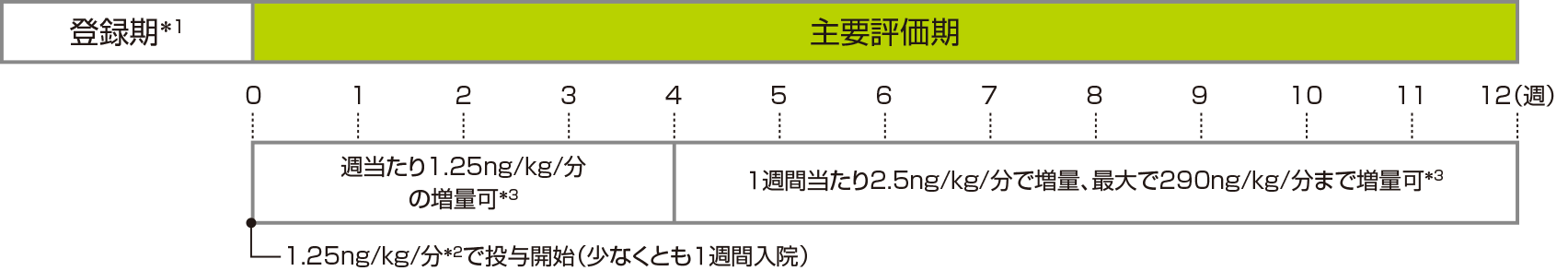
トレプロスチニルの開始用量を1.25ng/kg/分とし、1日24時間、連日12週間静脈内投与した(下図参照)。静脈内投与は、中心静脈カテーテルを留置し、中心静脈内へ投与した。カテーテル交換時等は一時的に末梢静脈内への投与を許容した。また、有害事象の発現等により医師が必要と判断した場合、同じ投与量で投与経路の変更を許容した。
投与スケジュール
減量する場合は、原則、1週間当たり2.5ng/kg/分以下ずつとした。ただし、有害事象の発現やトレプロスチニルの投与を中止し、他のPAH治療の開始が必要となるなど、緊急を要する場合は、急激な減量に伴うリバウンドに注意しながら、1週間当たり2.5ng/kg/分を超えた減量を許容した。
- *1:登録期における最初の有効性及び安全性評価(有害事象を除く)実施から治験薬投与開始まで最大2週間とした。
- *2:忍容性に問題が認められた場合は0.625ng/kg/分に減量した。
- *3:治験責任(分担)医師が、トレプロスト注射液の忍容性に問題がなく、かつ増量することにより効果が期待できると判断した場合、有害事象の発現に注意しながら、さらなる増量を許容した。
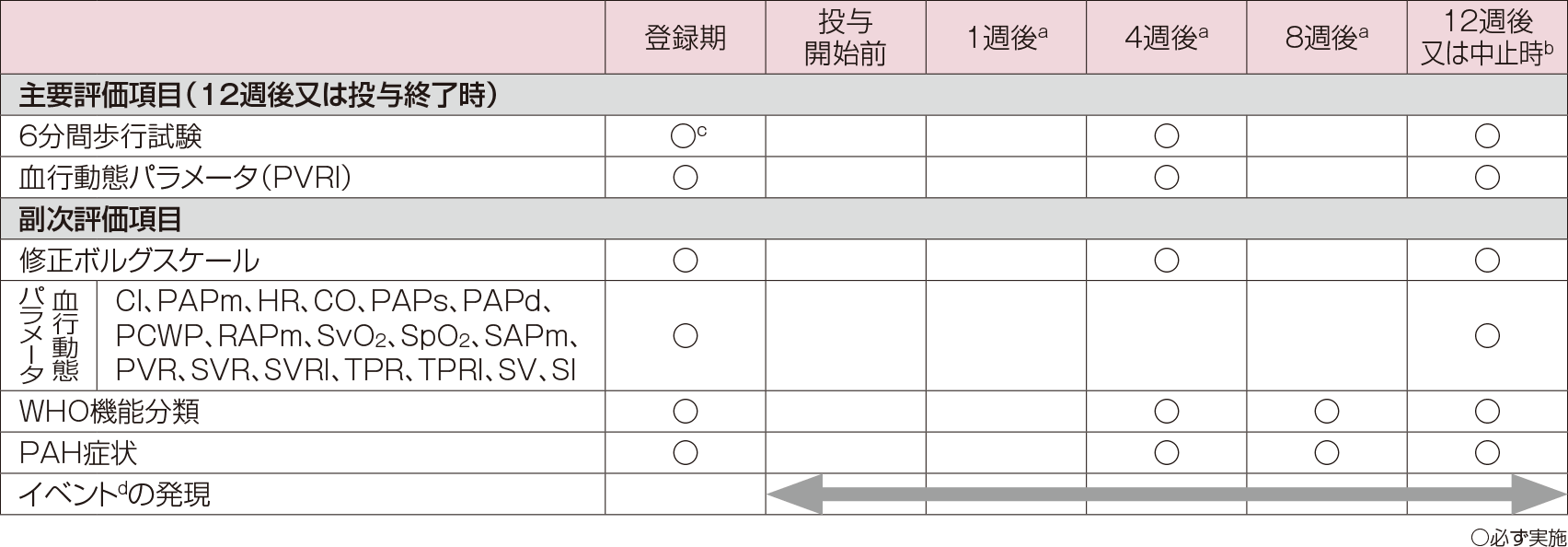
評価項目
略語一覧
- PVRI:肺血管抵抗係数
- CI:心係数
- PAPm:平均肺動脈圧
- HR:心拍数
- CO:心拍出量
- PAPs:収縮期肺動脈圧
- PAPd:拡張期肺動脈圧
- PCWP:肺毛細血管楔入圧
- RAPm:平均右心房圧
- SvO2:混合静脈血酸素飽和度
- SpO2:経皮的動脈血酸素飽和度
- SAPm:平均全身動脈圧
- PVR:肺血管抵抗
- SVR:体血管抵抗
- SVRI:体血管抵抗係数
- TPR:全肺抵抗
- TPRI:全肺抵抗係数
- SV:一回拍出量
- SI:一回拍出係数
安全性評価項目
有害事象、他
- a:許容範囲内で投与経路変更時の観察、検査及び評価を実施した場合、同じ観察、検査及び評価の実施は不要。
- b:10~12週の間で投与経路変更時の観察、検査及び評価を実施した場合、12週後の観察、検査及び評価の実施は不要。
- c:同意取得前6週間以内に6分間歩行試験を実施した経験がない場合は、6分間歩行の練習を実施してから行った。
- d:評価時期の設定のみで評価項目としての定義なし。
- e:PAH症状の悪化による次のいずれかのイベント:「併用禁止薬及び併用禁止療法の使用、又は併用禁止薬及び併用禁止療法使用のための中止」、「最初の入院」、「死亡」。
解析計画
(主要評価期のみについて記載)
(1)有効性の評価
- 1)主要評価項目:6分間歩行距離の変化量および血行動態パラメータ(PVRI)の変化量について要約統計量を算出した。
- 2)副次評価項目:修正ボルグスケールの変化量およびその他の血行動態パラメータの変化量について、要約統計量を算出した。また、WHO機能分類の推移、PAH症状の推移を示した。
- 3)欠測データの補完方法:6分間歩行距離、修正ボルグスケールは、臨床的悪化により未実施の場合は、それぞれ0m、10に補完した。それ以外の理由により未実施の場合は、投与後のデータを対象に直前のデータをLOCF(Last Observation Carried Forward)で補完した。その他の有効性評価項目のデータが欠測となった場合、投与後のデータを対象にLOCFで補完した。