- 医療関係者向けホーム
- 循環器領域
- トレプロスト®注射液
- Information:安全性
 Information
Information
安全性
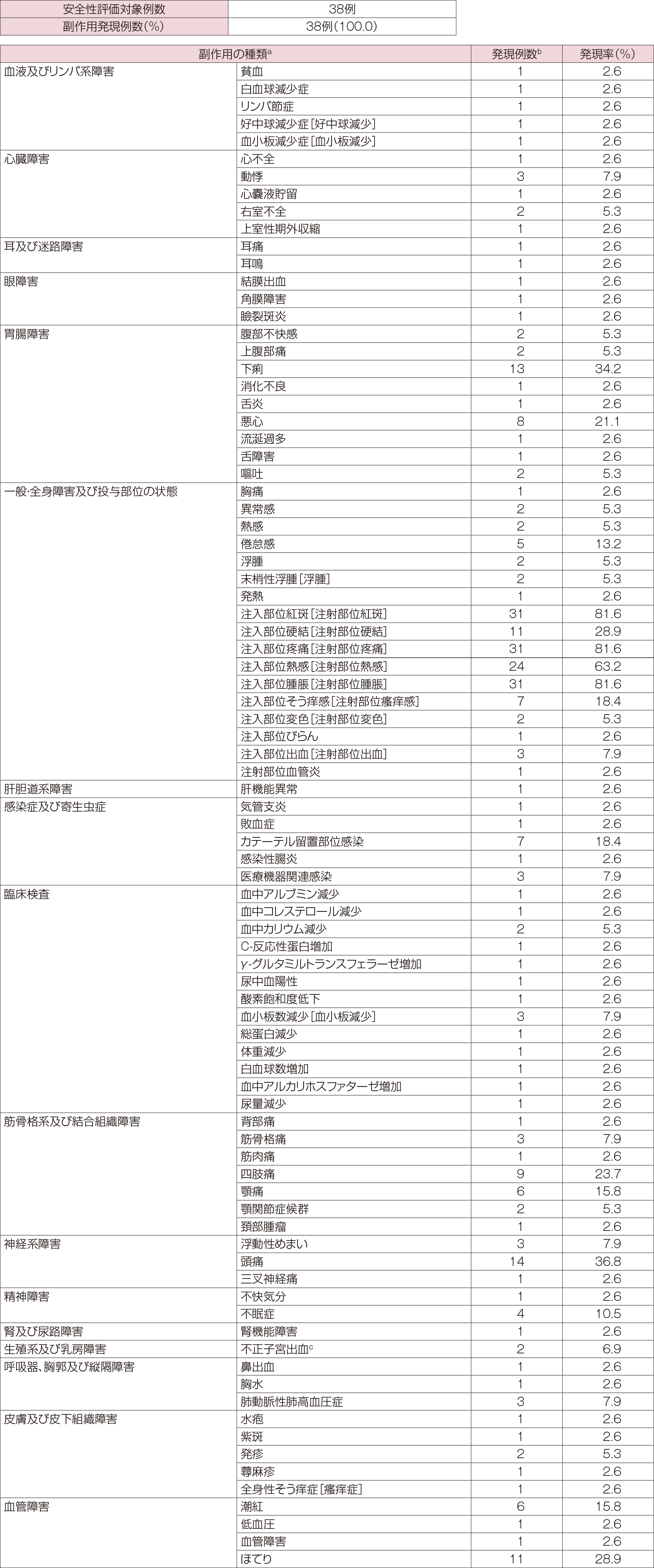
承認時までの国内臨床試験における副作用発現状況は以下の通りであった。
<国内>
皮下投与又は静脈内投与時の国内臨床試験において、総症例38例中、38例334件(100%)に臨床検査値異常を含む副作用が認められた。その主なものは注射部位の局所反応(疼痛、紅斑、腫脹、熱感、硬結、瘙痒感等)31例(82%)、頭痛14例(37%)、下痢13例(34%)、ほてり11例(29%)、四肢痛9例(24%)、悪心8例(21%)、潮紅6例(16%)、顎痛6例(16%)、倦怠感5例(13%)、不眠症4例(11%)、血小板減少4例(11%)、浮腫4例(11%)等であった。
なお、投与経路別では、皮下投与時で31例中31例205件(100%)、静脈内投与時で23例中20例129件(87%)に副作用が認められた(集計は副作用発現時の投与経路別とした)。その主なものは、皮下投与時で注射部位の局所反応(疼痛、紅斑、腫脹、熱感、硬結、瘙痒感等)31例(100%)、静脈内投与時で頭痛10例(43%)、下痢9例(39%)、ほてり8例(35%)、四肢痛8例(35%)、顎痛6例(26%)、倦怠感5例(22%)等であった。
- a:副作用の分類名、副作用名はMedDRA/J(Ver.15.0)の器官別大分類、基本語を用いて表示した。
[ ]内の表記は、添付文書で使用している副作用名を表示した。 - b:MD070123P21試験は投与48週(主要評価期+継続投与期1~3期)まで、MD070123P22試験は投与12週(主要評価期)までの集計を示した。
- c:女性での発現率を示した。
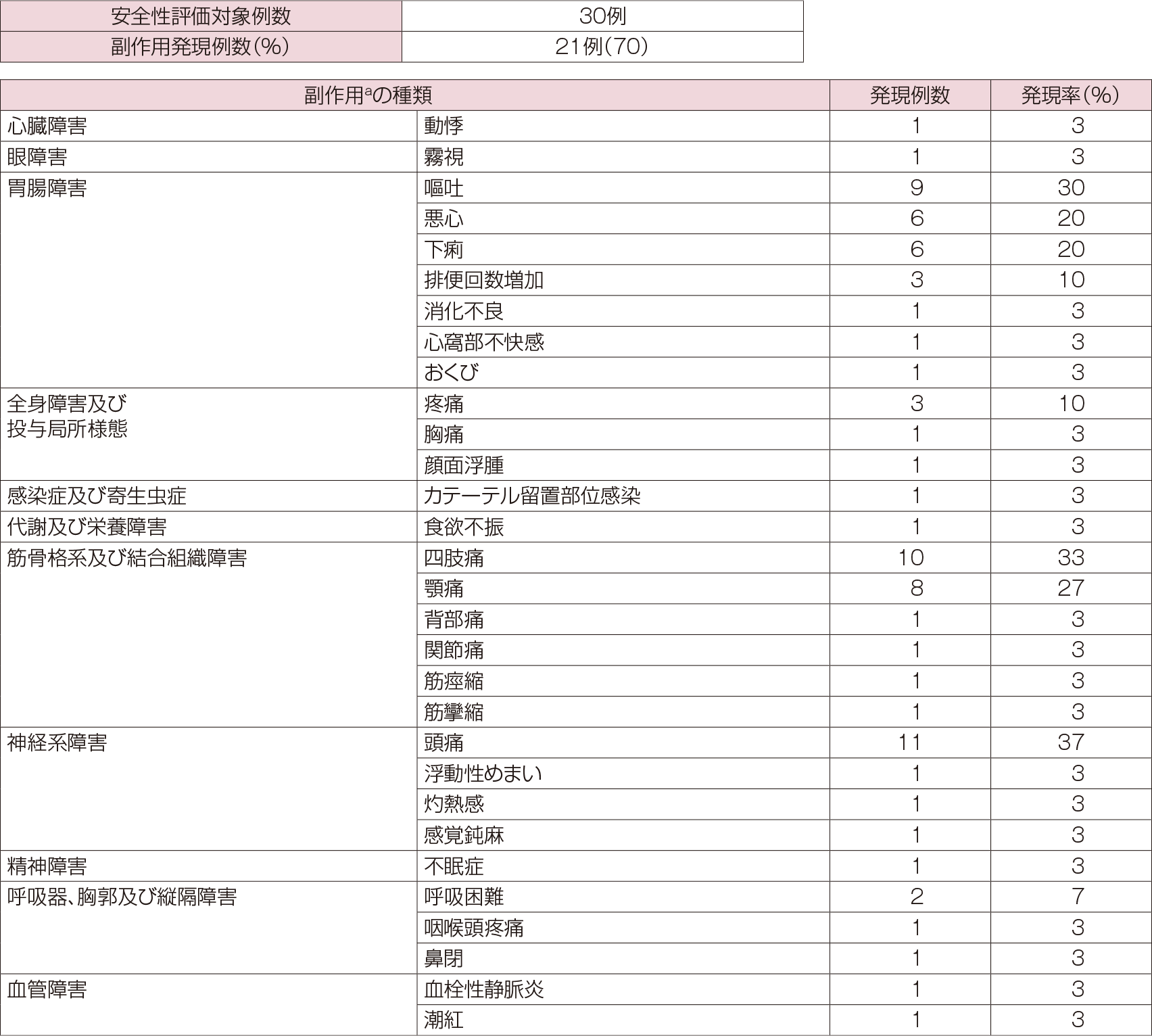
承認時までの海外臨床試験における副作用発現状況は以下の通りであった。
<海外>
皮下投与時の海外臨床試験(236例)における主な副作用は、注射部位疼痛200例(85%)、注射部位反応196例(83%)、頭痛55例(23%)、下痢51例(22%)、注射部位出血/挫傷50例(21%)、悪心44例(19%)、顎痛30例(13%)、発疹27例(11%)等であった。
- a:COSTART(FDAによって作成され、公表された用語体系:Coding Symbol for Thesaurus of Adverse Reaction Terms)ver.5
- b:腹痛、背部痛、乳房痛、胸痛、側腹部痛(pain)、注射部位疼痛、頚部痛、骨盤痛以外の疼痛(pain)、筋痙攣又は疼痛(ache)
- c:注入部位の紅斑、硬結、熱/灼熱感、そう痒など(注入部位疼痛、注入部位出血/挫傷以外)
静脈内投与時の海外臨床試験(30例)における主な副作用は、頭痛11例(37%)、四肢痛10例(33%)、嘔吐9例(30%)、顎痛8例(27%)、下痢6例(20%)、悪心6例(20%)、排便回数増加3例(10%)、疼痛3例(10%)等であった。
- a:MedDRA 8.1