- 医療関係者向けホーム
- 循環器領域
- トレプロスト®注射液
- Clinical Study:長期投与試験 試験の概要
 Clinical Study長期投与試験
Clinical Study長期投与試験
試験の概要「長期投与試験(本データは2012年1月時点のもの)1,2)」
- 1)持田製薬社内資料:国内患者対象試験(2014年3月24日承認、CTD 2.7.6.7.1)<承認時評価資料>
- 2)大森庸子ほか:Prog Med 34, 333-348(2014)
[利益相反:共同執筆者(京谷晋吾)は、トレプロスチニルのPAHの治験の医学専門家を務めた。
また、著者に持田製薬株式会社の社員が含まれている。本論文の作成、出版に関する費用は持田製薬株式会社が負担した。]
「警告、禁忌を含む使用上の注意」等は電子添文をご参照ください。
試験デザイン
多施設共同、非盲検、非ランダム化、非対照試験
目的
国内第Ⅱ/Ⅲ相試験において、継続投与期参加の同意が得られた肺動脈性肺高血圧症患者を対象として、トレプロスチニルの長期投与における有効性及び安全性を検討した。
対象
国内第Ⅱ/Ⅲ相試験の主要評価期にトレプロスチニルを投与された肺動脈性肺高血圧症患者33例。(継続投与期参加は25例)
投与方法
12週間の主要評価期終了後(投与方法)、トレプロスチニルの投与を継続した。継続投与期においては、理由を問わず、投与経路(皮下投与又は静脈内投与)の変更を許容した。継続投与期におけるトレプロスチニルの投与速度は、1週間当たり最大2.5ng/kg/分までの増量を可とし、最大投与量290ng/kg/分までの増量を可とした。また、減量する場合は、原則、1週間当たり2.5ng/kg/分以下とした。
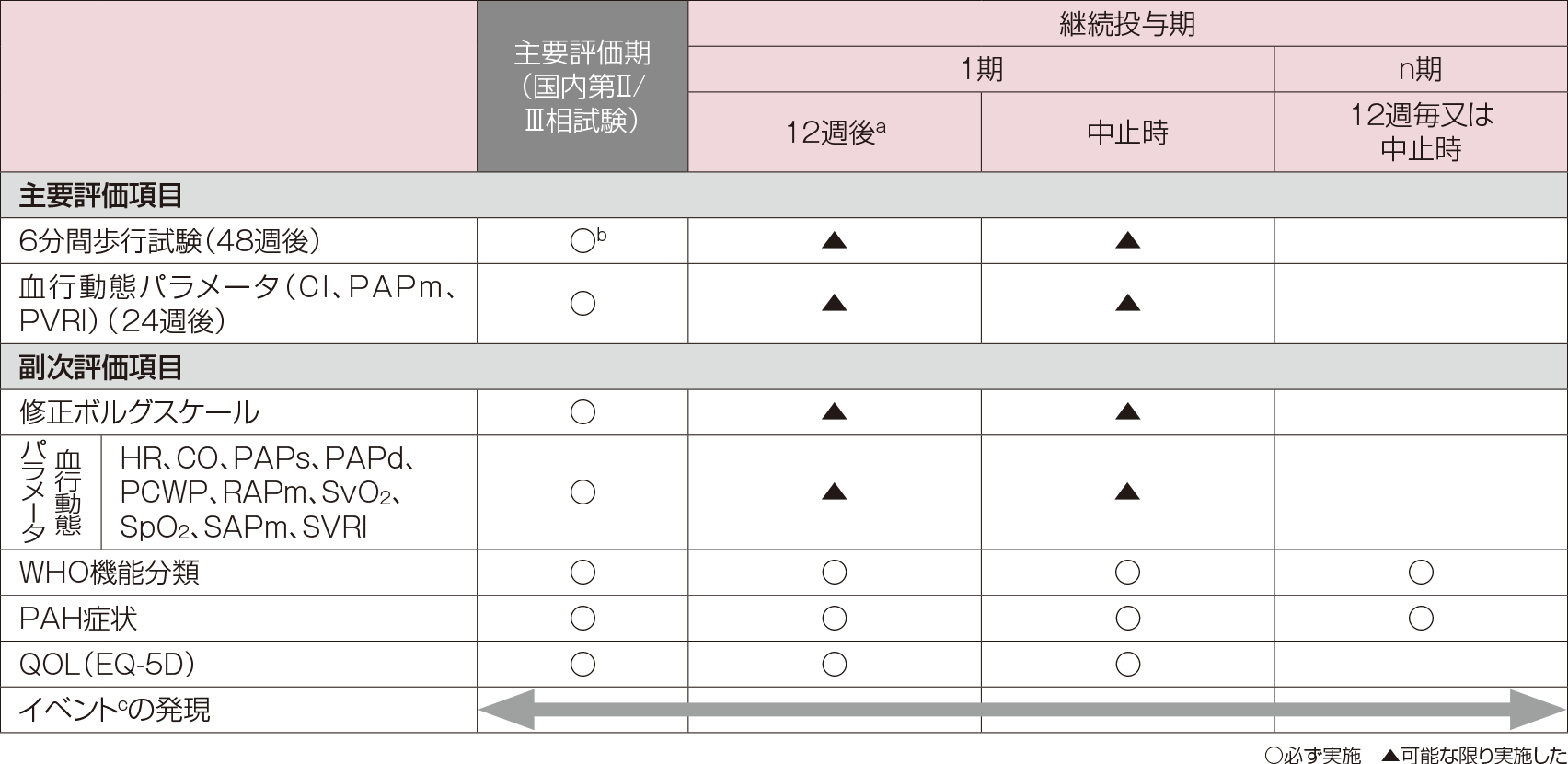
評価項目
略語一覧
- PVRI:肺血管抵抗係数
- CI:心係数
- PAPm:平均肺動脈圧
- HR:心拍数
- CO:心拍出量
- PAPs:収縮期肺動脈圧
- PAPd:拡張期肺動脈圧
- PCWP:肺毛細血管楔入圧
- RAPm:平均右心房圧
- SvO2:混合静脈血酸素飽和度
- SpO2:経皮的動脈血酸素飽和度
- SAPm:平均全身動脈圧
- PVR:肺血管抵抗
- SVR:体血管抵抗
- SVRI:体血管抵抗係数
- TPR:全肺抵抗
- TPRI:全肺抵抗係数
- SV:一回拍出量
- SI:一回拍出係数
安全性評価項目
有害事象、他
- a:継続投与期1期の基準日前2週間以内に投与経路変更時の観察、検査及び評価を実施した場合、継続投与期1期の観察、検査及び評価の実施は不要とした。
- b:主要評価期(12週)を含む投与開始時からの時点。
- c:同意取得前6週間以内に6分間歩行試験を実施した経験がない場合は、6分間歩行の練習を実施してから行った。
- d:臨床症状の悪化による次のいずれかのイベント:「併用禁止薬及び併用禁止療法の使用、又は併用禁止薬及び併用禁止療法使用のための中止」、「最初の入院」、「死亡」。
解析計画
(1)有効性の評価項目
- 1)主要評価項目:6分間歩行距離の変化量および血行動態パラメータ(CI、PAPm、PVRI)の変化量について中央値[25%点-75%点]を算出した。
- 2)副次評価項目:修正ボルグスケールの変化量およびPAH症状の改善スコアの変化量について、中央値[最小値-最大値]を算出した。また、WHO機能分類の変化を算出した。また、トレプロスチニル投与開始時から死亡発現までの時間についてKaplan-Meierプロットを作成した。
- 3)欠測データの補完方法:6分間歩行距離、修正ボルグスケールは、臨床的悪化により未実施の場合は、それぞれ0 m、10に補完した。それ以外の理由により未実施の場合は、直前のデータをLOCFで補完した。 PAH症状改善スコアは、中止の理由が臨床的悪化の場合は、-5点に補完し、それ以外の理由により中止の場合は、投与後のデータを対象にLOCFで補完した。