- 医療関係者向けホーム
- 循環器領域
- トレプロスト®注射液
- Clinical Study:海外第Ⅲ相試験の2試験(プラセボ対照皮下投与試験)併合解析(海外データ) 試験の概要
 Clinical Study海外第Ⅲ相試験の2試験(プラセボ対照皮下投与試験)併合解析
Clinical Study海外第Ⅲ相試験の2試験(プラセボ対照皮下投与試験)併合解析
(海外データ)
試験の概要「海外第Ⅲ相試験の2試験(プラセボ対照皮下投与試験;P01:04試験、
P01:05試験)併合解析(海外データ)1,2)」
- 1)持田製薬社内資料(海外プラセボ対照試験)<承認時評価資料>
- 2)Simonneau G, et al.: Am J Respir Crit Care Med 165, 800-804(2002)
[利益相反:本試験はUnited Therapeutics社の支援により実施]
「警告、禁忌を含む使用上の注意」等は電子添文をご参照ください。
試験デザイン
多施設共同、二重盲検、ランダム化、プラセボ対照、並行群間比較試験
目的
トレプロスチニルを12週間持続皮下投与したときの有効性、安全性を検討した。
対象
8~75歳の肺動脈性肺高血圧症患者469例(トレプロスチニル群233例、プラセボ群236例)
- NYHA心機能分類:Ⅱ~Ⅳ度
-
前毛細血管性肺高血圧症:原発性肺高血圧症、強皮症、限局性強皮症、混合性結合組織病、全身性エリテマトーデス、重複症候群に伴う肺高血圧症、先天性短絡性心疾患に伴う肺高血圧症
-
心臓カテーテル検査:平均肺動脈圧≧25mmHg(安静時)、肺毛細血管楔入圧又は左室拡張終期圧≦15mmHg、肺血管抵抗>3mmHg・分/L
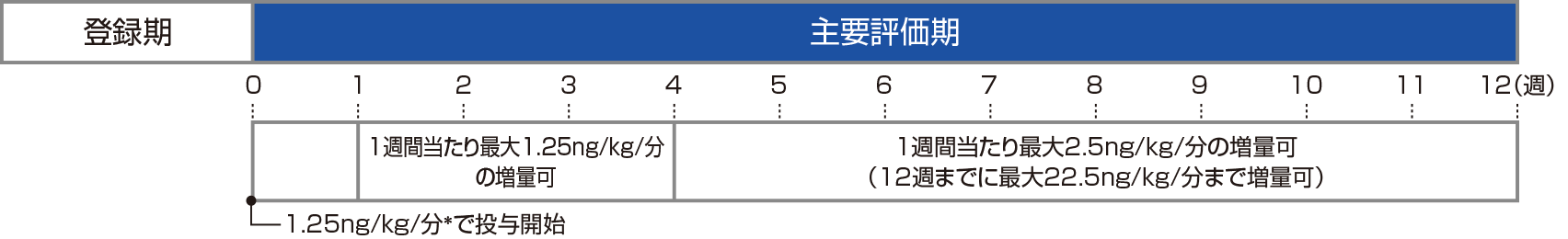
投与方法
トレプロスチニルの開始用量は1.25ng/kg/分とし、連日、1日24時間、注入ポンプを用いて持続皮下投与した。PAHの徴候及び症状、有害事象に基づいて用量を調整した。
評価項目
略語一覧
- PVRI:肺血管抵抗係数
- CI:心係数
- PAPm:平均肺動脈圧
- HR:心拍数
- CO:心拍出量
- PAPs:収縮期肺動脈圧
- PAPd:拡張期肺動脈圧
- PCWP:肺毛細血管楔入圧
- RAPm:平均右心房圧
- SvO2:混合静脈血酸素飽和度
- SpO2:経皮的動脈血酸素飽和度
- SAPm:平均全身動脈圧
- PVR:肺血管抵抗
- SVR:体血管抵抗
- SVRI:体血管抵抗係数
- TPR:全肺抵抗
- TPRI:全肺抵抗係数
- SV:一回拍出量
- SI:一回拍出係数
安全性評価項目
有害事象、他
- a:練習として登録前6週間の間で実施した。
- b:投与前値として心臓カテーテル前に実施した。練習から6時間経ていれば登録1日目に実施しても可とした。
解析計画
併合解析はCPMPの「Points to consider on Application with 1. Meta-Analysis; 2.One Pivotal Study guidance」に従い、有意水準は0.01とした。
(1)有効性の評価項目
- 1)主要評価項目
主要評価項目は、6分間歩行距離の登録時からの変化量(12週時)の投与群間の差とした。6分間歩行距離は登録時の6分間歩行距離、実施医療機関、その他の共変量を調整因子としたノンパラメトリックANCOVAを用いて解析した。6分間歩行距離の補完方法は、歩行できなかった理由が臨床的悪化の場合は0mを、それ以外の理由の場合はLOCF(Last Observation Carried Forward)で補完した。
PAH徴候および症状、呼吸困難−疲労度評定、死亡、移植および臨床的悪化に伴う中止ならびに1週時および6週時の6分間歩行距離を主要評価項目を補足する項目とし、PAH徴候および症状、呼吸困難−疲労度評定についてはWilcoxon順位和検定を用いて解析した。 - 2)副次評価項目
副次評価項目は、修正ボルグスケール、QOL、血行動態パラメータとし、修正ボルグスケール、QOLについてはWilcoxon順位和検定を用いて解析し、血行動態パラメータについては登録時の値を共変量とした共分散分析を用いて解析した。