- 医療関係者向けホーム
- 消化器領域
- アダリムマブBS「MA」
- Clinical Study:国際共同第Ⅲ相試験(LG-ALCL002試験) 安全性
 Clinical Study国際共同第Ⅲ相試験(LG-ALCL002試験)
Clinical Study国際共同第Ⅲ相試験(LG-ALCL002試験)
安全性
有害事象の要約と重篤な感染症
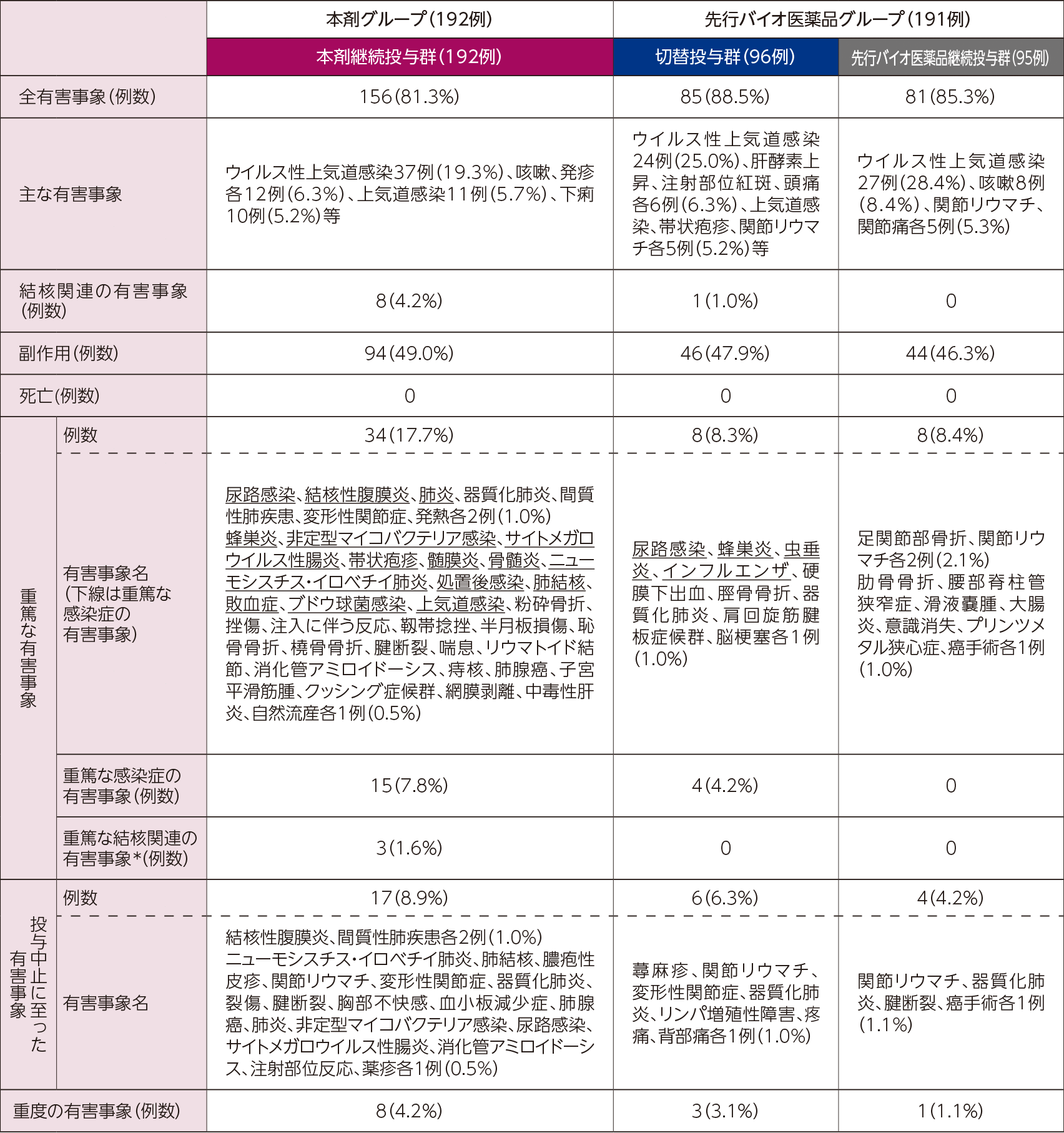
投与期及び後観察期における有害事象の発現例数は、本剤継続投与群、切替投与群及び先行バイオ医薬品継続投与群で156/192例(81.3%)、85/96例(88.5%)及び81/95例(85.3%)に認められた。副作用、重篤な有害事象、治験薬の投与中止に至った有害事象及び死亡は下表の通りであった。
- *:重篤な感染症の有害事象に含まれる。
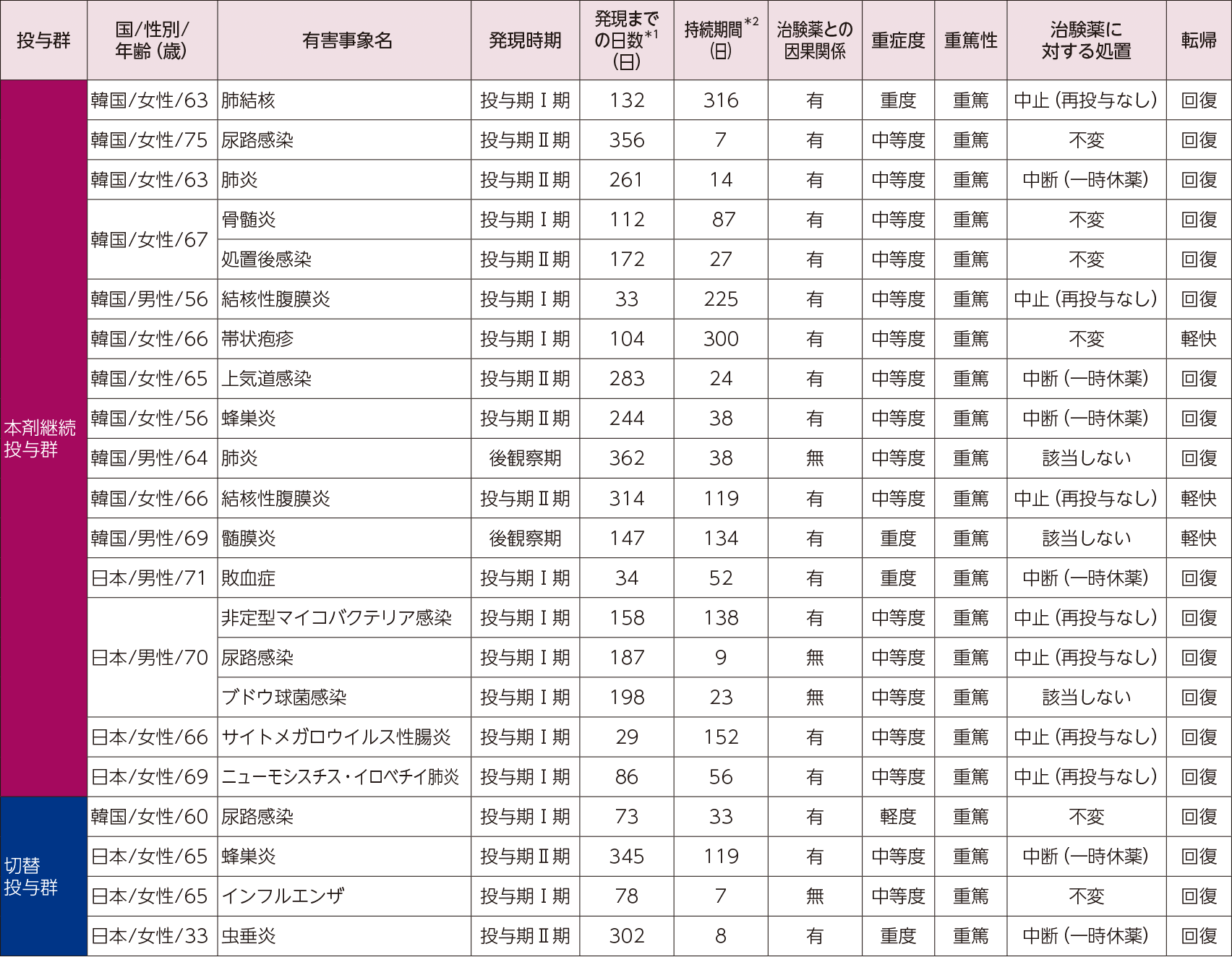
重篤な感染症が発現した患者の内訳は、本剤継続投与群は日本4例、韓国11例、切替投与群は日本3例(先行バイオ医薬品投与時に1例、本剤投与時に2例)、韓国1例(先行バイオ医薬品投与時)であった。本剤継続投与群及び切替投与群で認められた重篤な感染症は、処置後感染を除き、いずれも先行バイオ医薬品の市販後の投与例においても報告されている事象であり、転帰は回復又は軽快であった。
結核関連の有害事象で、臨床症状を呈した重篤な結核関連の有害事象の発現例は本剤継続投与群で3/192例(1.6%)、切替投与群で0/96例(0%)、先行バイオ医薬品継続投与群で0/95例(0%)であり、その他は臨床症状を呈さず、結核検査(IFN-γ遊離試験及び胸部X線検査)の結果より有害事象と判断された例であった。重篤な結核関連の有害事象が発現した患者の3例は、いずれも韓国例であった。この3例は、いずれも抗結核薬を投与し、転帰は回復又は軽快であった。
- ※切替投与群の投与期Ⅰ期は先行バイオ医薬品投与、投与期Ⅱ期は本剤投与
- *1:有害事象発現日-投与開始日+1
- *2:有害事象回復日又は転帰確認日-有害事象発現日+1
重篤な感染症の発現率に対する多変量ロジスティック回帰モデル※を用いた解析の結果、「肺疾患の合併」について重篤な感染症のリスク因子として有意な傾向が認められ、「副腎皮質ホルモン剤併用」についても重篤な感染症のリスク因子としての傾向が認められた。本剤継続投与群において、ベースライン時における「副腎皮質ホルモン剤併用」かつ「肺疾患の合併」の該当例及び非該当例における重篤な感染症の有害事象の発現率は、それぞれ18.9%(7/37例)及び5.2%(8/155例)であり、非該当例に比し該当例で3倍程度高値であった。
- ※:投与群(本剤継続投与群、先行バイオ医薬品継続投与群)、副腎皮質ホルモン剤併用の有無、肺疾患の合併の有無を共変量とした。 本解析は事前に規定されたものではないが、審査過程において審査当局からの要求に応え実施したものである。
なお、先行バイオ医薬品の使用成績調査1)においても、感染症のリスク因子について、多変量ロジスティック回帰モデルを用い解析しており、結果は以下のとおりであった。
- ・「加齢」及び「肺疾患の既往又は合併」は、すべての感染症のリスク因子であった。
- ・「8mg/週を超えるMTX併用」は、感染症、呼吸器感染症、重篤な呼吸器感染症及び肺炎のリスク因子であった。
- ・「5mg/日(プレドニゾロン換算)を超える副腎皮質ホルモン剤併用」は、感染症、重篤な感染症及び重篤な呼吸器感染症のリスク因子であった。
- ・「糖尿病の合併」は、感染症及び重篤な感染症のリスク因子であった。
本剤は、細胞性免疫反応を調節するTNFαの生理活性を抑制するため、感染症に対する宿主免疫能に影響を及ぼす可能性があります。結核を含む重篤な感染症は、本剤使用時の重大な副作用です。本剤の投与にあたっては、電子添文の警告、重要な基本的注意、重大な副作用の項をご参照ください。また、内容の詳細は、審査報告書をご参照ください。
先行バイオ医薬品から本剤への切替投与における安全性の検討
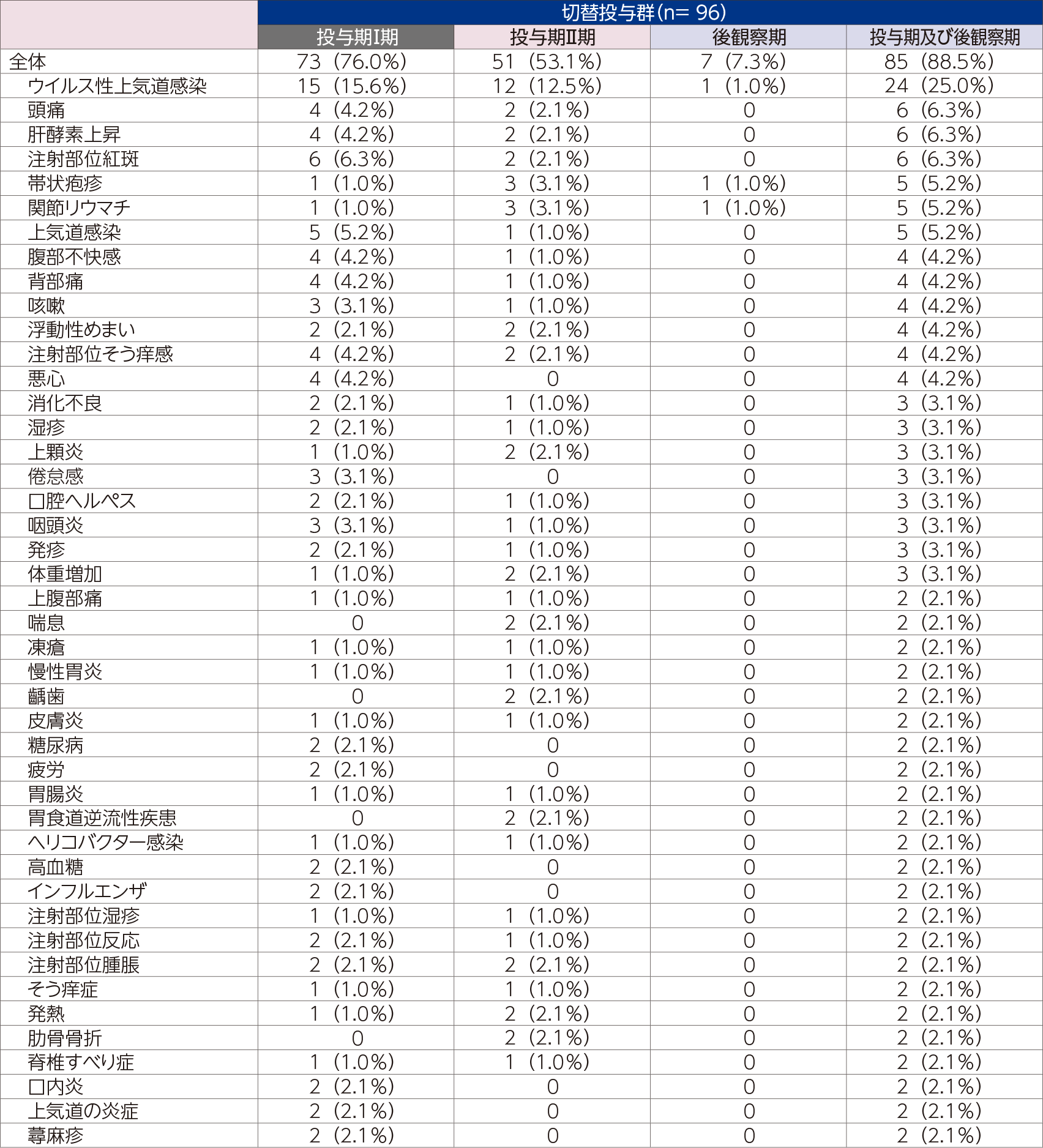
投与期及び後観察期における切替投与群の有害事象は85/96例(88.5%)に認められた。主な有害事象は、ウイルス性上気道感染24例(25.0%)、頭痛、肝酵素上昇及び注射部位紅斑各6例(6.3%)等であった。
- ※切替投与群の投与期Ⅰ期は先行バイオ医薬品投与、投与期Ⅱ期は本剤投与
- MedDRA ver.20.0
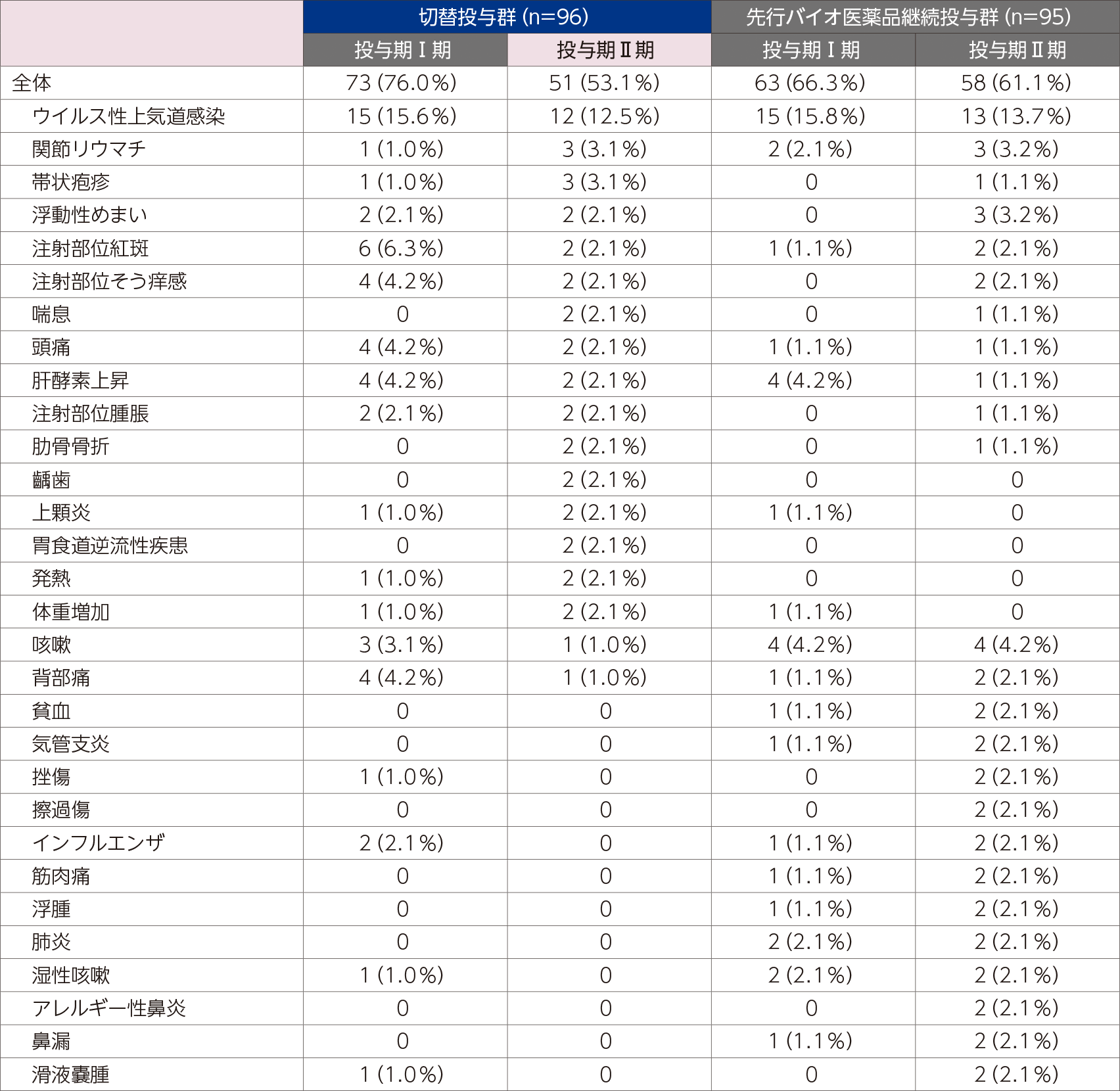
切替投与群において、投与期Ⅱ期(本剤投与時)の発現率が投与期Ⅰ期(先行バイオ医薬品投与時)に比べ高値であった有害事象は、帯状疱疹、関節リウマチ、上顆炎、体重増加、喘息、齲歯、胃食道逆流性疾患、発熱及び肋骨骨折であったが、いずれも非重篤で治験薬の投与中止には至らず、重度の有害事象は認められなかった。さらに、投与期Ⅰ期及び投与期Ⅱ期を跨いで発現した有害事象について、治験薬の切替投与前後で重症度が悪化した事象は認められなかった。
投与期Ⅱ期において、切替投与群の発現率が先行バイオ医薬品継続投与群に比べ2%以上高値であった有害事象は、帯状疱疹、齲歯、上顆炎、胃食道逆流性疾患、発熱及び体重増加であったが、いずれも非重篤で治験薬の投与中止には至らず、重度の有害事象は認められなかった。
- ※切替投与群の投与期Ⅰ期は先行バイオ医薬品投与、投与期Ⅱ期は本剤投与
- MedDRA ver.20.0
副作用(国際共同第Ⅲ相試験:本剤継続投与群における副作用)
本剤40mgを2週に1回投与された関節リウマチ患者を対象とした国際共同第Ⅲ相試験の本剤継続投与群において、安全性解析対象症例192例中94例(49.0%)に副作用が認められた。
- MedDRA ver.20.0
- 1)Koike T, et al. Mod Rheumatol. 2014;24:390
- 2)持田製薬社内資料(国際共同第Ⅲ相試験)(承認時評価資料)