- 医療関係者向けホーム
- 循環器領域
- トレプロスト®吸入液
- Information:薬物動態
 Information
Information
薬物動態
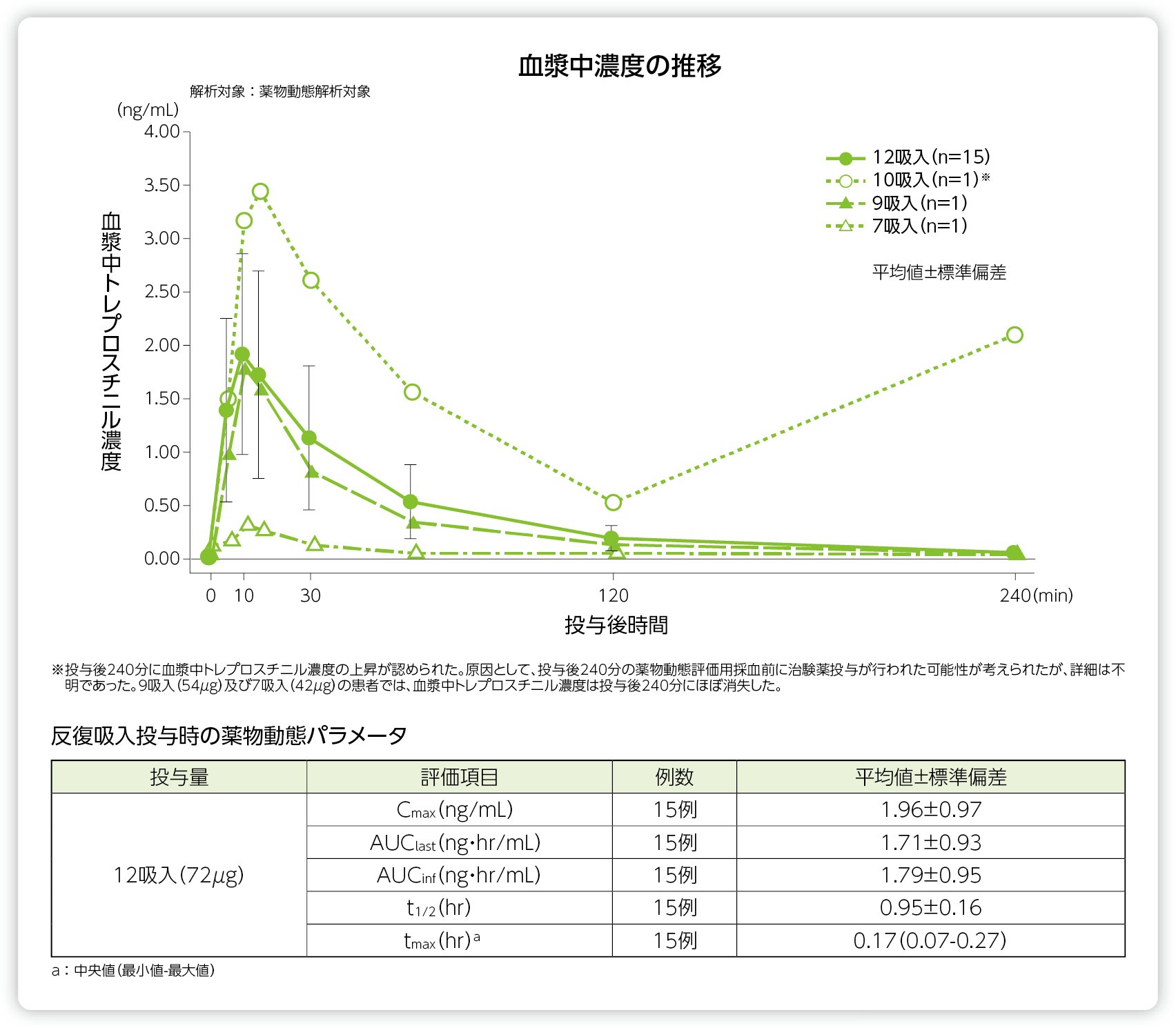
血漿中濃度
(2)反復投与(吸入投与)2)
PAH患者にトレプロスチニルを12週間、1日4回吸入投与したときの血漿中濃度推移及び薬物動態パラメータは以下の通りであった。
12週時におけるトレプロスチニルの1回の投与量が9吸入(54μg)であった12例において、12週時のトレプロスチニル投与後10分に血漿中濃度(平均値±標準偏差)は最高値(0.99±0.56ng/mL)に達し、12週時における各薬物動態パラメータ(平均値±標準偏差)は、Cmaxが1.03±0.54ng/mL、AUClastが0.99±0.57ng・hr/mL、AUCinfが1.05±0.60ng・hr/mL及びt1/2が0.72±0.11hrであり、tmax(中央値(最小値-最大値))は0.167(0.07-1.02)hrであった。
(3)反復投与(吸入投与)3)
ILD-PH(CPFEを含む)患者にトレプロスチニルを16週間、1日4回吸入投与したときの血漿中濃度推移及び薬物動態パラメータは以下の通りであった。
16週時におけるトレプロスチニルの1回の投与量が12吸入(72μg)であった15例において、16週時のトレプロスチニル投与後10分に血漿中濃度(平均値±標準偏差)は最高値(1.91±0.94ng/mL)に達し、16週時における薬物動態パラメータ(平均値±標準偏差)は、Cmaxが1.96±0.97ng/mL、AUClastが1.71±0.93ng・hr/mL、AUCinfが1.79±0.95ng・hr/mL及びt1/2が0.95±0.16hrであり、tmax(中央値(最小値-最大値))は0.17(0.07-0.27)hrであった。
6. 用法及び用量
〈肺動脈性肺高血圧症〉
通常、成人には、1日4回ネブライザを用いて吸入投与する。1回3吸入(トレプロスチニルとして18μg)から投与を開始し、忍容性を確認しながら、7日以上の間隔で、1回3吸入ずつ、最大9吸入(トレプロスチニルとして54μg)まで漸増する。3吸入の増量に対して忍容性に懸念がある場合は、増量幅を1又は2吸入としてもよい。忍容性がない場合は減量し、1回最小量は1吸入とすること。
〈間質性肺疾患に伴う肺高血圧症〉
通常、成人には、1日4回ネブライザを用いて吸入投与する。1回3吸入(トレプロスチニルとして18μg)から投与を開始し、忍容性を確認しながら、3日以上の間隔で、1回1吸入ずつ、最大12吸入(トレプロスチニルとして72μg)まで漸増する。忍容性がない場合は減量し、1回最小量は1吸入とすること。
相互作用
- ※トレプロスチニルの経口剤は国内未承認です。
10. 相互作用
本剤は主にCYP2C8により代謝される。[16.4 参照]
- 10.2 併用注意(併用に注意すること)(抜粋)
CYP2C8誘導剤
- リファンピシン 等
本剤のAUC及びCmaxが低下し、本剤の効果が減弱するおそれがある。肺高血圧症状の観察を十分に行うこと。
CYP2C8阻害剤
- デフェラシロクス
本剤のAUC及びCmaxが上昇し、本剤の副作用が発現するおそれがある。
- 1)持田製薬社内資料:国内第Ⅰ相試験(トレプロスト吸入液:2022年12月23日承認、CTD 2.7.6.1)
- 2)持田製薬社内資料:国内第Ⅱ/Ⅲ相試験(トレプロスト吸入液:2022年12月23日承認、CTD 2.7.6.8)
- 3)持田製薬社内資料:国内第Ⅱ/Ⅲ相試験(トレプロスト吸入液、CTD 2.7.6.2)
- 4)持田製薬社内資料:海外アセトアミノフェン薬物相互作用試験(トレプロスト注射液:2014年3月24日承認、CTD2.7.6.4.1)
- 5)Wade M, et al.: J Cardiovasc Pharmacol. 2003; 41(6): 908-915[利益相反:本試験はUnited Therapeutics社の支援(出資、共著者の一部)により実施]
- 6)Gotzkowsky SK, et al.: J Clin Pharmacol. 2010; 50(7): 829-834[利益相反:本試験はUnited Therapeutics社の支援(出資、共著者の一部)により実施]
- 7)持田製薬社内資料:海外シルデナフィル薬物相互作用試験(トレプロスト注射液:2014年3月24日承認、CTD2.7.6.4.4)
- 8)持田製薬社内資料:海外CYP2C8/2C9誘導剤薬物相互作用試験(トレプロスト注射液:2014年3月24日承認、CTD2.7.6.4.5)
- 9)持田製薬社内資料:海外CYP2C8/2C9阻害剤薬物相互作用試験(トレプロスト注射液:2014年3月24日承認、CTD2.7.6.4.6)
2025年11月作成
17050-14/N6 60 GMJ