- 医療関係者向けホーム
- 循環器領域
- トレプロスト®吸入液
- Information:製品管理に関する情報
 Information
Information
製品管理に関する情報
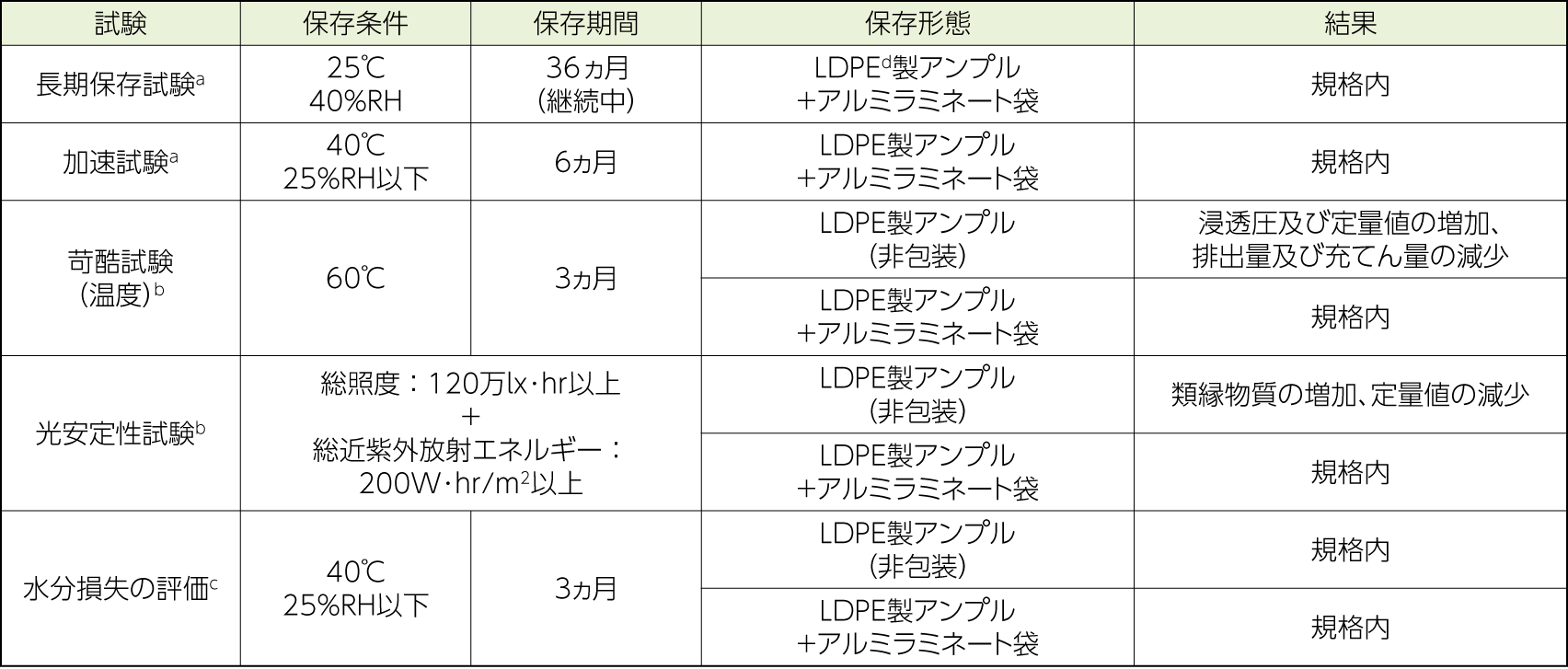
製剤学的事項
- a:試験項目:性状、確認試験、pH、純度試験(類縁物質)、無菌、定量法、浸透圧、不溶性微粒子、排出量及び充てん量
- b:試験項目:性状、確認試験、pH、純度試験(類縁物質)、定量法、浸透圧、不溶性微粒子、排出量及び充てん量
- c:試験項目:水分損失
- d:LDPE:Low density polyethylene:低密度ポリエチレン
- 持田製薬社内資料:トレプロスト吸入液1.74mg 製剤の安定性に関する資料(2023年1月11日作成、2025年1月27日改訂、CTD 2.3.P.8)
2)他剤との配合変化(物理化学的変化)
配合変化試験を実施していないので、他の薬剤との混合は避けること。
取扱い上の注意
-
- 取扱い上の注意:アルミ袋開封後は遮光して保存すること。
- 規制区分:劇薬、処方箋医薬品注)
注)注意−医師等の処方箋により使用すること- 貯法:室温保存
- 有効期間:48箇月
包装
アンプル:2.9mL×30管(1袋中に6管×5袋)
2025年11月作成
17050-14/N6 60 GMJ