- 医療関係者向けホーム
- 循環器領域
- トレプロスト®注射液
- Clinical Study:国内第Ⅱ/Ⅲ相試験(エポプロステノール未使用例を対象とした試験:皮下投与又は静脈内投与試験) 安全性
 Clinical Study国内第Ⅱ/Ⅲ相試験(エポプロステノール未使用例を対象とした
Clinical Study国内第Ⅱ/Ⅲ相試験(エポプロステノール未使用例を対象とした
試験:皮下投与又は静脈内投与試験)
安全性
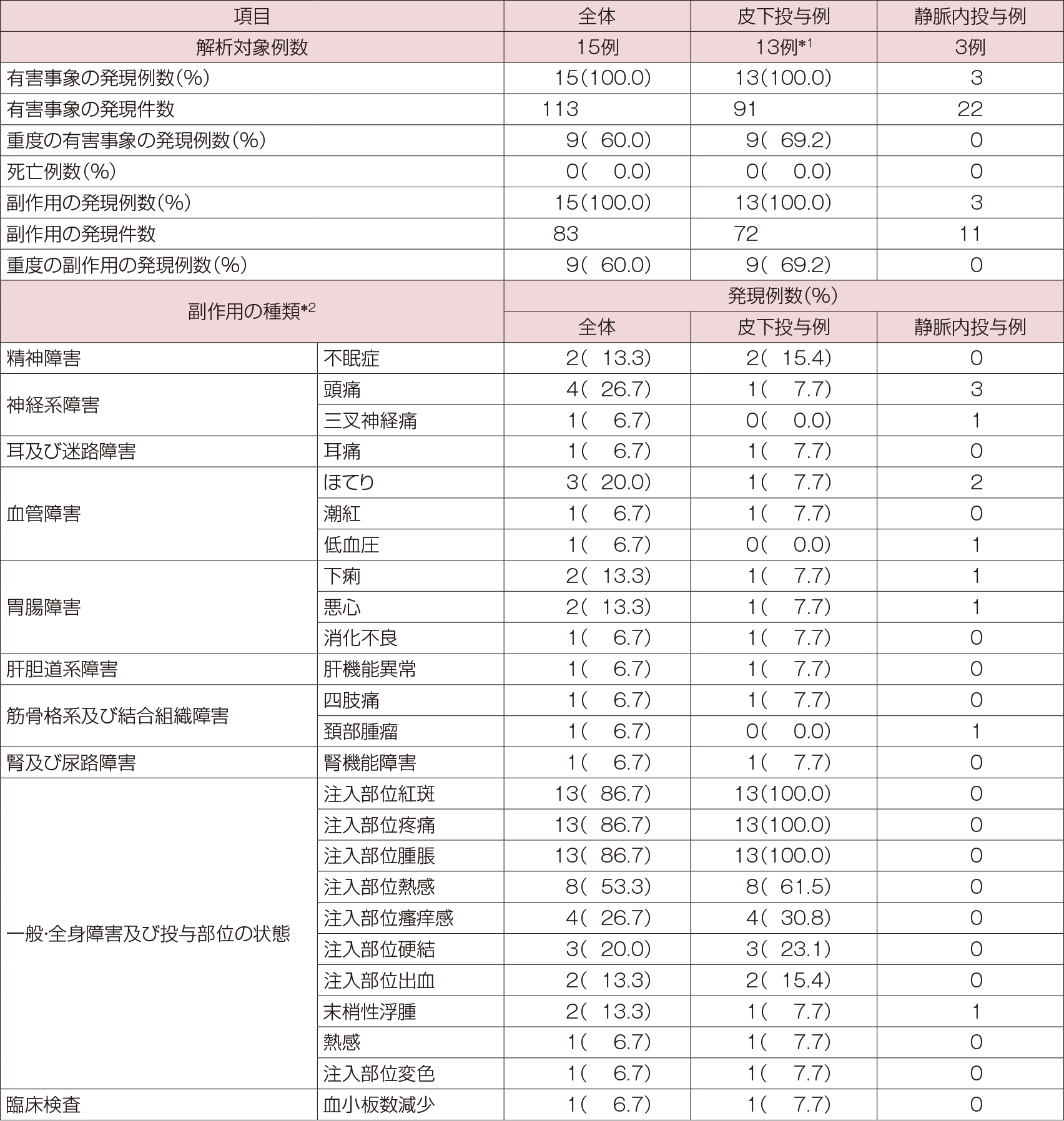
有害事象は、皮下投与、静脈内投与それぞれ13/13例 91件、3/3例 22件に認められ、副作用はそれぞれ13/13例 72件、3/3例 11件であった。重度の有害事象は、皮下投与で69.2%(9/13例)に認められ、静脈内投与では認められなかった。重度の有害事象の内訳は、注入部位疼痛69.2%(9例)、注入部位紅斑、注入部位腫脹、注入部位熱感各15.4%(2例)、右室不全7.7%(1例)であった。中止に至った有害事象は、皮下投与で46.2%(6/13例)に認められ、静脈内投与では認められなかった。重篤な有害事象は、皮下投与で右室不全7.7%(1/13例)が認められ、静脈内投与では認められなかった。中止理由は注入部位疼痛46.2%(6/13例)、注入部位腫脹15.4%(2例)、注入部位熱感及び注入部位紅斑7.7%(各1例)であった。死亡は両投与経路ともに認められなかった。主な副作用は注入部位の局所反応(紅斑、疼痛、腫脹)が各86.7%(13/15例)、注入部位熱感が53.3%(8例)、頭痛及び注入部位瘙痒感が、各26.7%(4例)であった。
- *1:皮下投与例の安全性解析対象例数は、皮下投与開始例12例と、静脈内投与開始例3例のうち、静脈内投与から皮下投与へ投与経路を変更した1例の計13例であった。
- *2:副作用名はMedDRA/J ver15.0に基づき、器官別大分類に分類し、基本語を記載した。