- 医療関係者向けホーム
- 消化器領域
- コレチメント®錠
- Clinical Study:CORE Ⅱ試験(海外第Ⅲ相試験) 海外データ 臨床的・内視鏡的寛解が認められた被験者の割合
 Clinical StudyCORE Ⅱ試験(海外第Ⅲ相試験) 海外データ
Clinical StudyCORE Ⅱ試験(海外第Ⅲ相試験) 海外データ
臨床的・内視鏡的寛解が認められた被験者の割合
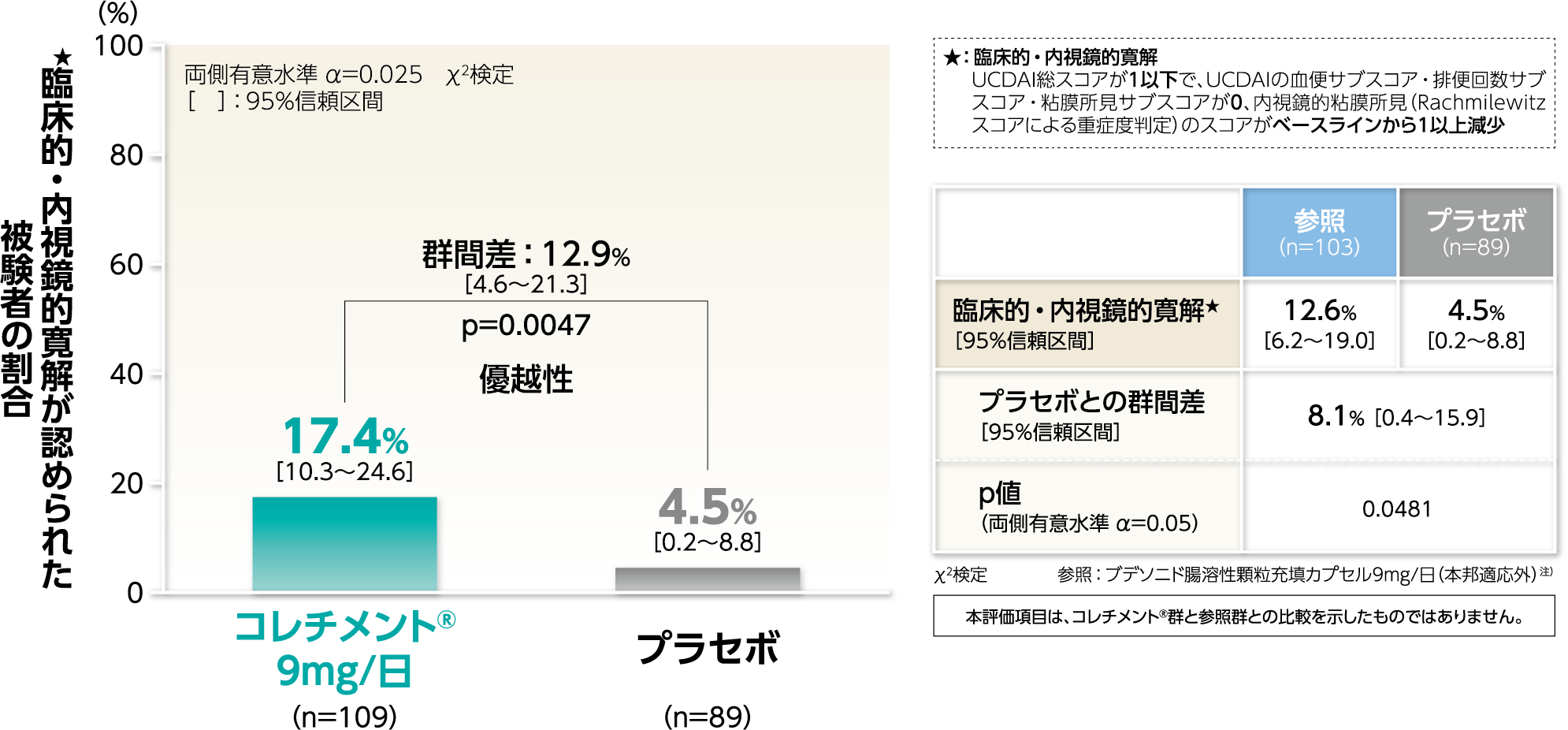
主要評価項目投与後8週時に臨床的・内視鏡的寛解★が認められた被験者の割合検証的解析結果
投与後8週時に臨床的・内視鏡的寛解★が認められた被験者の割合は、コレチメント®9mg/日群では17.4%、プラセボ群では4.5%と、群間差は12.9%であり、コレチメント®9mg/日群のほうが統計学的に有意に高いことが示され、プラセボ群に対する優越性が検証されました(p=0.0047、χ2検定)。
投与後8週時に臨床的・内視鏡的寛解★が認められた被験者の割合〔ITT解析対象集団(Worst case)〕
- 社内資料:海外第Ⅲ相試験(2023年6月26日承認、CTD 2.7.6.9) 〈承認時評価資料〉
- 【4. 効能又は効果】
- 活動期潰瘍性大腸炎(重症を除く)
- 【6. 用法及び用量】
- 通常、成人にはブデソニドとして9mgを1日1回朝経口投与する。
注)ブデソニド腸溶性顆粒充填カプセルは、潰瘍性大腸炎治療剤としては本邦適応外です。ブデソニド腸溶性顆粒充填カプセルの【効能又は効果】は下記の通りです。
【4. 効能又は効果】軽症から中等症の活動期クローン病
2024年9月作成
17309-6/N4 B2 MDC