- 医療関係者向けホーム
- 消化器領域
- オンボー®
- Information:薬物動態
 Information
Information
薬物動態
血中濃度
単回投与(外国人データを含む)
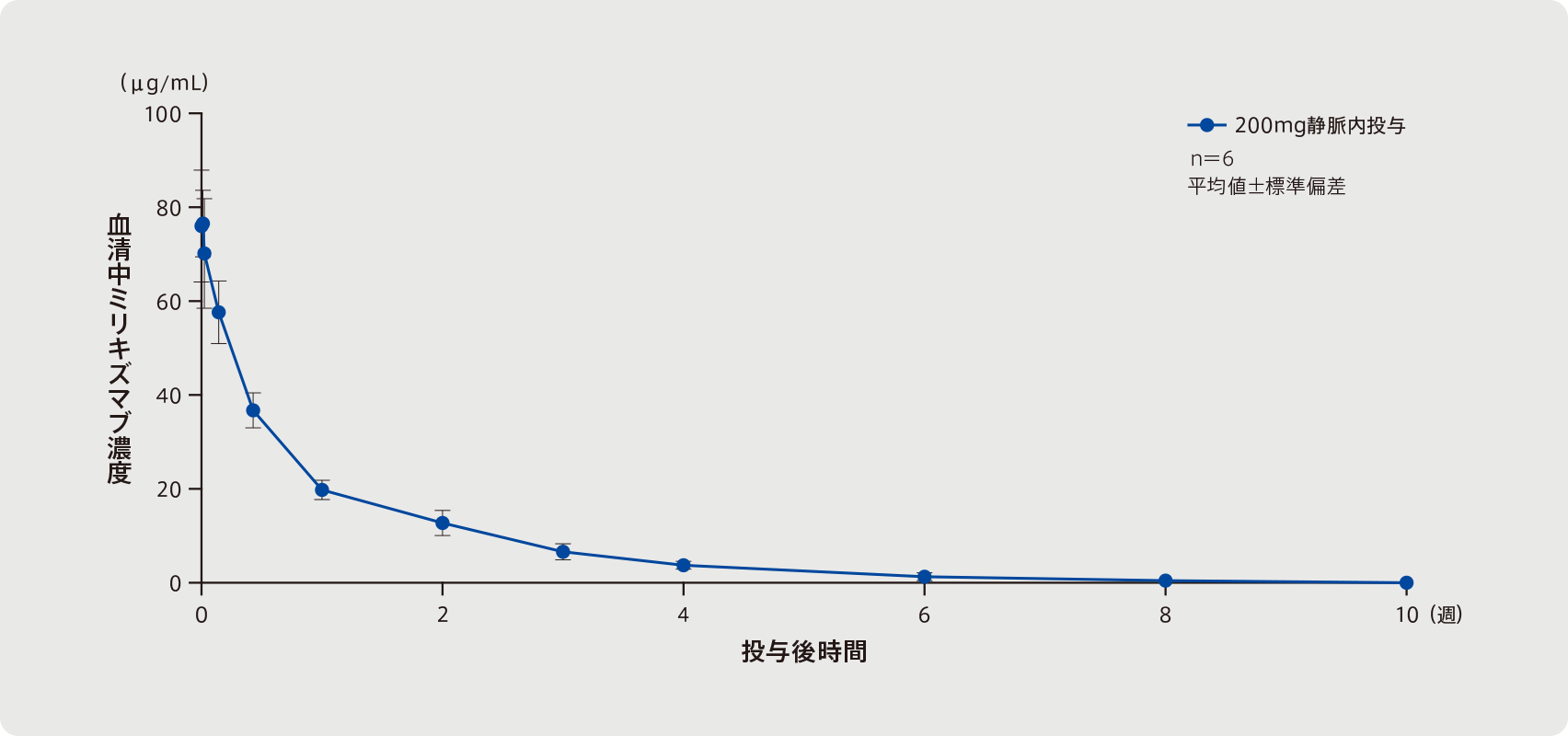
オンボー®点滴静注
日本人及び外国人健康成人各3例にミリキズマブ200mgを単回静脈内投与したとき、血清中ミリキズマブ濃度は約10日の消失半減期で低下した。AUC0-∞及びCmaxの幾何平均値(変動係数%)は、それぞれ539μg・day/mL(12%)及び78.8μg/mL(13%)であった。
| 略語 | Cmax=最高血清中濃度、tmax=最高血清中濃度到達時間、t1/2=消失半減期、 AUC0-∞=0時間から無限時間までの血清中濃度‐時間曲線下面積、CL=全身クリアランス、Vz=終末相における分布容積 |
|---|
幾何平均値(変動係数%)
a 中央値[範囲]
| 対象 | 日本人及び外国人健康成人各3例 |
|---|---|
| 方法 | ミリキズマブ200mgを単回静脈内投与した。 |
- 社内資料:日本人及び外国人健康成人を対象としたミリキズマブの第Ⅰ相試験
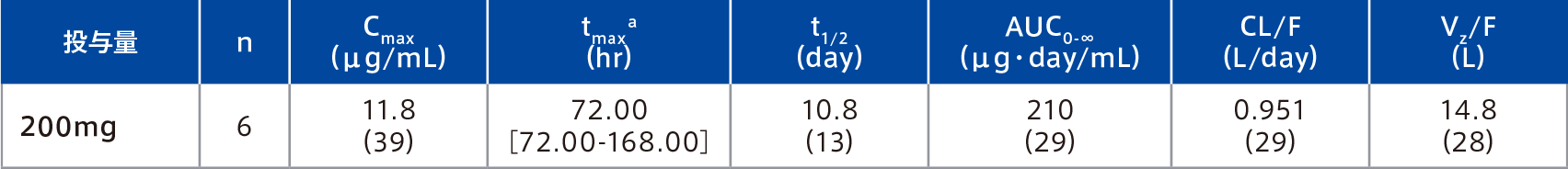
オンボー®皮下注
日本人及び外国人健康成人各3例にミリキズマブ200mgを単回皮下投与したとき、血清中ミリキズマブ濃度は投与3日後に最高濃度に達した後、約11日の消失半減期で低下した。AUC0-∞及びCmaxの幾何平均値(変動係数%)は、それぞれ210μg・day/mL(29%)及び11.8μg/mL(39%)であった。
| 略語 | Cmax=最高血清中濃度、tmax=最高血清中濃度到達時間、t1/2=消失半減期、 AUC0-∞=0時間から無限時間までの血清中濃度‐時間曲線下面積、CL/F=見かけの全身クリアランス、Vz/F=終末相における見かけの分布容積 |
|---|
幾何平均値(変動係数%)
a 中央値[範囲]
| 対象 | 日本人及び外国人健康成人各3例 |
|---|---|
| 方法 | ミリキズマブ200mgを単回皮下投与した。 |
- 社内資料:日本人及び外国人健康成人を対象としたミリキズマブの第Ⅰ相試験
反復投与(外国人データを含む)
潰瘍性大腸炎
オンボー®点滴静注
母集団薬物動態解析より、日本人潰瘍性大腸炎患者121例に本剤を用法及び用量(4週間隔で1回300mg)に従って静脈内投与したとき、血清中ミリキズマブのAUCτ,ss及びCmax,ssの幾何平均値(変動係数%)はそれぞれ664μg・day/mL(31%)及び110μg/mL(14%)と推定された。
母集団薬物動態モデルから得た個体別パラメータを要約した
| 略語 | AUCτ,ss=定常状態における投与間隔の血清中濃度–時間曲線下面積、 Cavg,ss=定常状態における1回の投与間隔の平均ミリキズマブ濃度、Cmax,ss=定常状態における最高血清中濃度、 Ctrough,ss=定常状態における次回投与直前のミリキズマブ濃度 |
|---|
幾何平均値(変動係数%)
| 対象 | 国際共同第Ⅲ相試験2試験〔LUCENT-1(AMAN)試験、LUCENT-2(AMBG)試験〕に参加した日本人及び外国人潰瘍性大腸炎患者(121例及び1008例) |
|---|---|
| 方法 | 潰瘍性大腸炎患者を対象とした国際共同第Ⅲ相試験2試験〔投与経路:LUCENT-1(AMAN)試験は静脈内投与、LUCENT-2(AMBG)試験は皮下投与〕で得られた本剤の薬物動態データ(1129 例)を用いて母集団薬物動態解析を実施し、日本人潰瘍性大腸炎患者121例にミリキズマブを用法及び用量(4週間隔で1回300mgを静脈内投与、又は4週間隔で1回200mgを皮下投与)に従って投与したときの薬物動態パラメータを推定した。 |
- 社内資料:ミリキズマブの薬物動態
オンボー®皮下注
母集団薬物動態解析より、日本人及び外国人潰瘍性大腸炎患者(121例及び1008例)に、本剤を用法及び用量(4週間隔で1回200mg)に従って投与したとき、血清中ミリキズマブ濃度は皮下投与開始後8週目までに定常状態に達した。
日本人潰瘍性大腸炎患者(121例)におけるミリキズマブのAUCτ,ss及びCmax,ssの幾何平均値(変動係数%)はそれぞれ205μg・day/mL(43%)及び12.4μg/mL(36%)と推定された。
母集団薬物動態モデルから得た個体別パラメータを要約した
| 略語 | AUCτ,ss=定常状態における投与間隔の血清中濃度–時間曲線下面積、 Cavg,ss=定常状態における1回の投与間隔の平均ミリキズマブ濃度、Cmax,ss=定常状態における最高血清中濃度、 Ctrough,ss=定常状態における次回投与直前のミリキズマブ濃度、tmax,ss=定常状態における最高血清中濃度到達時間 |
|---|
幾何平均値(変動係数%)
a 中央値[範囲]
| 対象 | 国際共同第Ⅲ相試験2試験〔LUCENT-1(AMAN)試験、LUCENT-2(AMBG)試験〕に参加した日本人及び外国人潰瘍性大腸炎患者(121例及び1008例) |
|---|---|
| 方法 | 潰瘍性大腸炎患者を対象とした国際共同第Ⅲ相試験2試験〔投与経路:LUCENT-1(AMAN)試験は静脈内投与、LUCENT-2(AMBG)試験は皮下投与〕で得られた本剤の薬物動態データ(1129 例)を用いて母集団薬物動態解析を実施し、日本人潰瘍性大腸炎患者121例にミリキズマブを用法及び用量(4週間隔で1回300mgを静脈内投与、又は4週間隔で1回200mgを皮下投与)に従って投与したときの薬物動態パラメータを推定した。 |
クローン病
オンボー®点滴静注
母集団薬物動態解析より、日本人クローン病患者12 例に本剤を用法及び用量(4 週間隔で1 回900mg)に従って静脈内投与したとき、血清中ミリキズマブのAUCτ,ss 及びCmax,ss の幾何平均値(変動係数%)はそれぞれ1860μg・day/mL(34%)及び345μg/mL(14%)と推定された。
| 略語 | AUCτ,ss=定常状態における投与間隔の血清中濃度–時間曲線下面積、Cmax,ss=定常状態における最高血清中濃度 |
|---|
| 対象 | 国際共同第Ⅲ相試験〔VIVID-1(AMAM)試験〕に参加した日本人クローン病患者(12 例) |
|---|---|
| 方法 | クローン病患者を対象とした国際共同第Ⅲ相試験〔VIVID-1(AMAM)試験〕で得られた本剤の薬物動態データ(711例)を用いて母集団薬物動態解析を実施し、日本人クローン病患者12 例にミリキズマブを用法及び用量(4 週間隔で1 回900mg を静脈内投与、又は4 週間隔で1 回300mg を皮下投与)に従って投与したときの薬物動態パラメータを推定した。 |
オンボー®皮下注
母集団薬物動態解析より、日本人クローン病患者12 例に本剤を用法及び用量(4 週間隔で1 回300mg)に従って投与したとき、血清中ミリキズマブのAUCτ,ss 及びCmax,ss の幾何平均値(変動係数%)はそれぞれ224μg・day/mL(42%)及び14.0μg/mL(34%)と推定された。
| 略語 | AUCτ,ss=定常状態における投与間隔の血清中濃度–時間曲線下面積、Cmax,ss=定常状態における最高血清中濃度 |
|---|
| 対象 | 国際共同第Ⅲ相試験〔VIVID-1(AMAM)試験〕に参加した日本人クローン病患者(12 例) |
|---|---|
| 方法 | クローン病患者を対象とした国際共同第Ⅲ相試験〔VIVID-1(AMAM)試験〕で得られた本剤の薬物動態データ(711例)を用いて母集団薬物動態解析を実施し、日本人クローン病患者12 例にミリキズマブを用法及び用量(4 週間隔で1 回900mg を静脈内投与、又は4 週間隔で1 回300mg を皮下投与)に従って投与したときの薬物動態パラメータを推定した。 |
- 社内資料:ミリキズマブの薬物動態
生物学的同等性試験(外国人データ)
オンボー®皮下注
注射部位疼痛の軽減を目的とした新規製剤(クエン酸非含有のミリキズマブ溶液製剤)を市販製剤とするために、生物学的同等性試験(AMBT試験及びAMBY試験)を実施し、新規製剤が薬物動態に及ぼす影響を評価した。なお、潰瘍性大腸炎及びクローン病患者を対象とした第Ⅲ相試験で使用した皮下投与用製剤は、既存製剤(クエン酸含有のミリキズマブ溶液製剤)である。
海外第Ⅰ相試験(AMBT試験):オートインジェクター
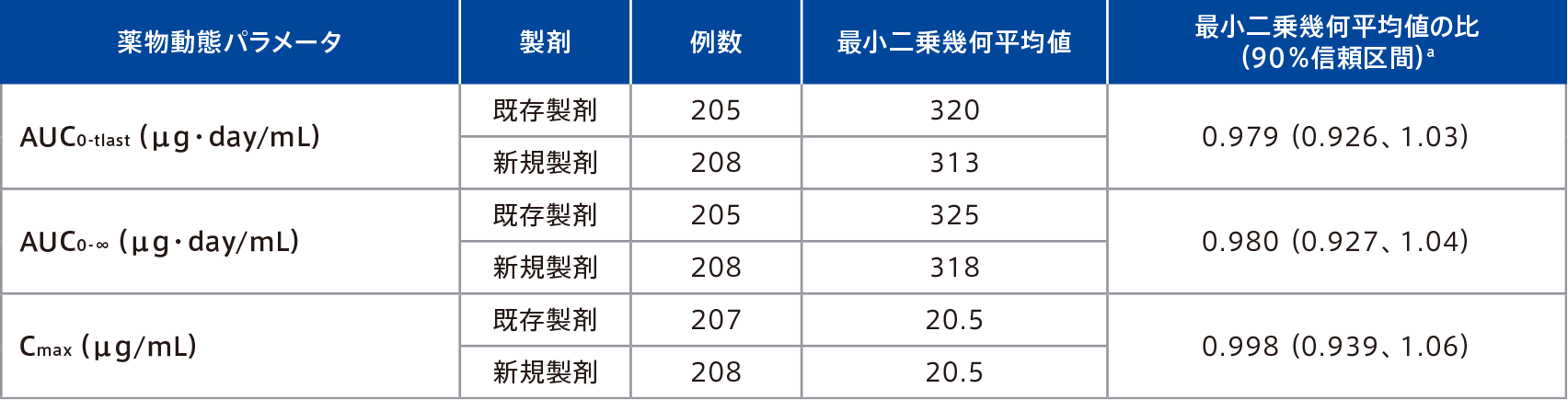
健康成人にクエン酸含有のミリキズマブ溶液製剤(既存製剤)又はクエン酸非含有のミリキズマブ溶液製剤(新規製剤)をオートインジェクターを用いて、ミリキズマブ200mg(100mg/mL溶液1mLを2回連続注射)を単回皮下投与したときの薬物動態パラメータは以下のとおりであった。
既存製剤に対する新規製剤のAUC0-tlast 、AUC0-∞及びCmaxの最小二乗幾何平均値の比の90%信頼区間は0.80~1.25の範囲内であったことから、既存製剤と新規製剤との生物学的同等性が示された。
| 略語 | AUC0-tlast=0時間から最終定量可能時点までの血清中濃度– 時間曲線下面積、 AUC0-∞=0時間から無限時間までの血清中濃度–時間曲線下面積、Cmax=最高血清中濃度 |
|---|
a 既存製剤に対する新規製剤の比
| 対象 | 健康成人396例 |
|---|---|
| 方法 | 被験者をいずれかの製剤〔クエン酸含有のミリキズマブ溶液製剤(既存製剤)又はクエン酸非含有のミリキズマブ溶液製剤(新規製剤)〕及び注射部位(上腕部、大腿部、又は腹部)に、以下のとおりに無作為化し、100mg/mLの新規製剤又は既存製剤でミリキズマブ200mg(100mg/mL溶液1mLを2回連続注射)を単回皮下投与した。 ・新規製剤:既存製剤=1:1 ・上腕部:大腿部:腹部=1:1:1(製剤別) |
海外第Ⅰ相試験(AMBY試験):プレフィルドシリンジ
健康成人にクエン酸含有のミリキズマブ溶液製剤(既存製剤)又はクエン酸非含有のミリキズマブ溶液製剤(新規製剤)をプレフィルドシリンジを用いて、ミリキズマブ300mg(100mg/mL溶液1mL及び2mLを各1回注射)を単回皮下投与したときの薬物動態パラメータは以下のとおりであった。
既存製剤に対する新規製剤のAUC0-tlast 、AUC0-∞及びCmaxの最小二乗幾何平均値の比の90%信頼区間は0.80~1.25の範囲内であったことから、既存製剤と新規製剤との生物学的同等性が示された。
| 略語 | AUC0-tlast=0時間から最終定量可能時点までの血清中濃度– 時間曲線下面積、 AUC0-∞=0時間から無限時間までの血清中濃度–時間曲線下面積、Cmax=最高血清中濃度 |
|---|
a 既存製剤に対する新規製剤の比
| 対象 | 健康成人450例 |
|---|---|
| 方法 | 被験者をいずれかの製剤〔クエン酸含有のミリキズマブ溶液製剤(既存製剤)又はクエン酸非含有のミリキズマブ溶液製剤(新規製剤)〕及び注射部位(上腕部、大腿部、又は腹部)に、以下のとおりに無作為化し、100mg/mLの新規製剤又は既存製剤でミリキズマブ300mg(100mg/mL溶液1mL及び2mLを各1回注射)を単回皮下投与した。 ・新規製剤:既存製剤=1:1 ・上腕部:大腿部:腹部=1:1:1(製剤別) |
オンボー®点滴静注の用法及び用量
〈潰瘍性大腸炎〉
通常、成人にはミリキズマブ(遺伝子組換え)として、1回300mgを4週間隔で3回(初回、4週、8週)点滴静注する。なお、12週時に効果不十分な場合はさらに1回300mgを4週間隔で3回(12週、16週、20週)投与することができる。
また、ミリキズマブ(遺伝子組換え)皮下投与用製剤による維持療法中に効果が減弱した場合には、1回300mgを4週間隔で3回点滴静注することができる。
〈クローン病〉
通常、成人にはミリキズマブ(遺伝子組換え)として、1回900mgを4週間隔で3回(初回、4週、8週)点滴静注する。
また、ミリキズマブ(遺伝子組換え)皮下投与用製剤による治療中に効果が減弱した場合には、1回900mgを4週間隔で3回点滴静注することができる。
オンボー®皮下注の用法及び用量
オンボー®皮下注100mgオートインジェクター
オンボー®皮下注100mgシリンジ
〈潰瘍性大腸炎〉
ミリキズマブ(遺伝子組換え)点滴静注製剤による導入療法終了4週後から、通常、成人にはミリキズマブ(遺伝子組換え)として1回200mgを4週間隔で皮下投与する。
〈クローン病〉
ミリキズマブ(遺伝子組換え)点滴静注製剤による治療終了4週後から、通常、成人にはミリキズマブ(遺伝子組換え)として1回300mgを4週間隔で皮下投与する。
オンボー®皮下注200mgオートインジェクター
オンボー®皮下注200mgシリンジ
〈クローン病〉
ミリキズマブ(遺伝子組換え)点滴静注製剤による治療終了4週後から、通常、成人にはミリキズマブ(遺伝子組換え)として1回300mgを4週間隔で皮下投与する。