- 医療関係者向けホーム
- 消化器領域
- オンボー®
- Information:免疫原性
 Information
Information
免疫原性(国際共同試験)
オンボー®点滴静注
オンボー®皮下注
潰瘍性大腸炎
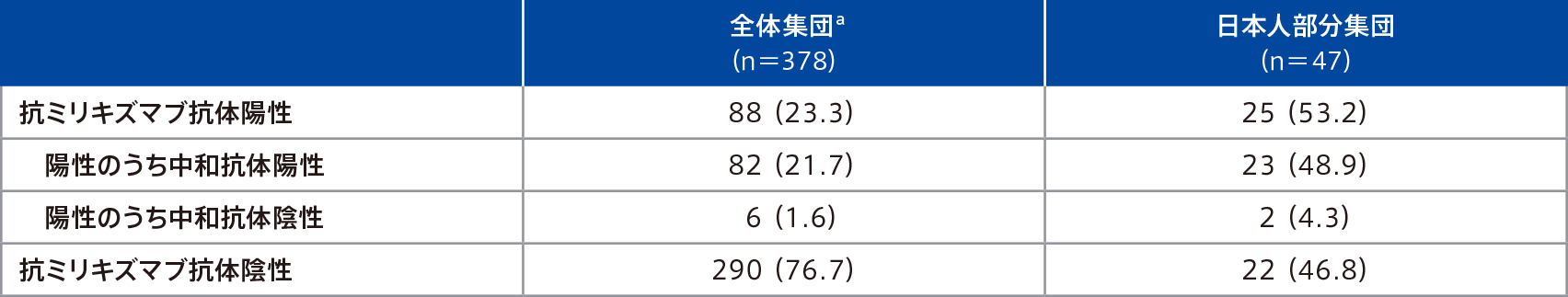
潰瘍性大腸炎患者を対象とした第Ⅲ相試験(LUCENT-1試験及びLUCENT-2試験を通した52週間)において、抗ミリキズマブ抗体検査が可能であった患者集団における抗ミリキズマブ抗体の発現状況は以下のとおりであった。
例数(%)
a 抗ミリキズマブ抗体の測定方法が異なる中国の患者を除く
抗ミリキズマブ抗体最大抗体価が1:160以上の患者32例のうち10例は、抗ミリキズマブ抗体の発現により血清中ミリキズマブ濃度が低下したと判定された注)。
注)以下の条件のすべてに合致する場合、抗ミリキズマブ抗体に関連した血清中ミリキズマブ濃度の低下があったと判定された。
- ①抗ミリキズマブ抗体最大抗体価が1:160以上。
- ②維持期にミリキズマブ濃度がカットオフ値(0.511μg/mL)未満に低下(カットオフ値は、LUCENT-2試験でオンボー®皮下注200mgを4週間隔で皮下投与された抗ミリキズマブ抗体陰性患者の4、12、24及び40週時点におけるトラフ濃度の5パーセンタイルから設定)。
- ③抗ミリキズマブ抗体発現後に血清中ミリキズマブ濃度が変化(②で定義)している。
試験概要は、LUCENT-1試験の試験概要及びLUCENT-2試験の試験概要参照
クローン病
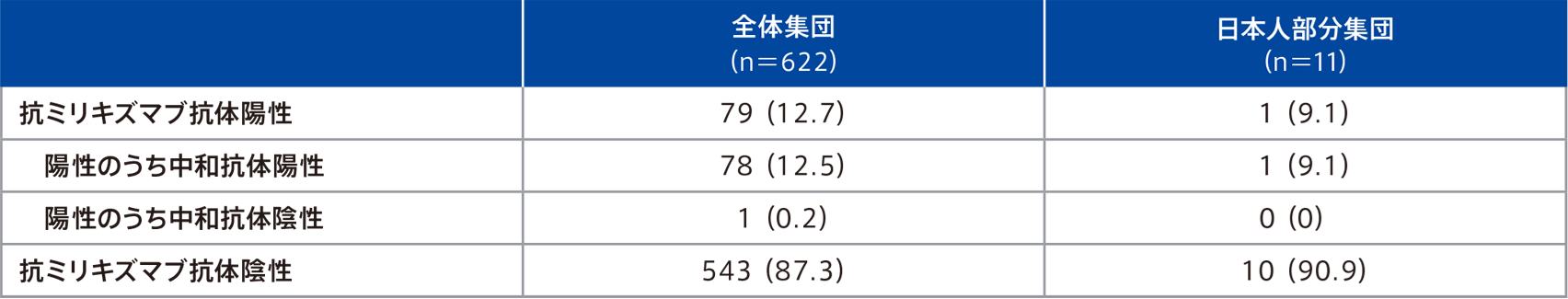
クローン病患者を対象とした第Ⅲ相試験(VIVID-1試験 第1期及び第2期の52週間)において、抗ミリキズマブ抗体検査が可能であった患者集団における抗ミリキズマブ抗体の発現状況は以下のとおりであった。
例数(%)
プラセボ群に割り付けられた12週時点のノンレスポンダーでオンボー®投与に移行した患者はオンボー®群に含まない
試験概要は、VIVID-1試験の試験概要参照
- 社内資料:ミリキズマブの免疫原性
オンボー®点滴静注の効能又は効果
- 〇中等症から重症の潰瘍性大腸炎の寛解導入療法(既存治療で効果不十分な場合に限る)
- 〇中等症から重症の活動期クローン病の治療(既存治療で効果不十分な場合に限る)
オンボー®皮下注の効能又は効果
オンボー®皮下注100mgオートインジェクター
オンボー®皮下注100mgシリンジ- 〇中等症から重症の潰瘍性大腸炎の維持療法(既存治療で効果不十分な場合に限る)
- 〇中等症から重症の活動期クローン病の治療(既存治療で効果不十分な場合に限る)
オンボー®皮下注200mgオートインジェクター
オンボー®皮下注200mgシリンジ- 〇中等症から重症の活動期クローン病の治療(既存治療で効果不十分な場合に限る)