- 医療関係者向けホーム
- 循環器領域
- トレプロスト®吸入液
- Clinical Study(肺動脈性肺高血圧症):海外第Ⅳ相試験 安全性
 Clinical Study海外第Ⅳ相試験(肺動脈性肺高血圧症)
Clinical Study海外第Ⅳ相試験(肺動脈性肺高血圧症)
安全性
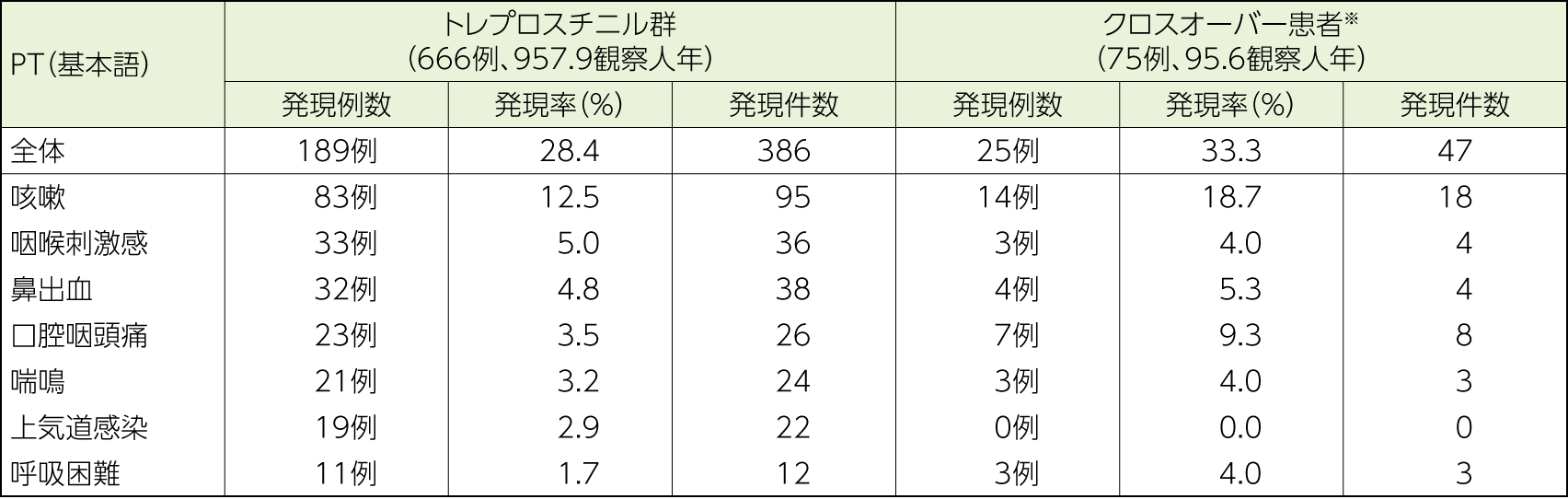
PAH患者を対象に、口腔・鼻咽頭及び肺関連(呼吸器関連)の副作用の種類及び発現率の検討を行った。
呼吸器関連副作用の発現率はトレプロスチニル群で28.4%(189/666例)、トレプロスチニル非投与群で11.4%(76/667例)であった。主な呼吸器関連副作用は、トレプロスチニル群で咳嗽83例(12.5%)、咽喉刺激感33例(5.0%)、鼻出血32例(4.8%)、トレプロスチニル非投与群で鼻出血21例(3.1%)、咳嗽7例(1.0%)、上気道感染6例(0.9%)であった。
重篤な呼吸器関連副作用はトレプロスチニル群で9例、トレプロスチニル非投与群で3例認められており、トレプロスチニル群で肺炎(4例)、上気道感染(2例)、ならびに呼吸不全、喀血、慢性閉塞性肺疾患、気管支炎、咳嗽、低酸素症、気道出血及び喘息(各1例)、トレプロスチニル非投与群で呼吸不全及び喀血(各1例)、ならびに鼻出血(1例)であった。
死亡に至った呼吸器関連副作用は認められなかった。
- 当該論文及び導入元より提供された資料には、トレプロスチニル群及びトレプロスチニル非投与群における
投与中止に至った呼吸器関連副作用の記載が認められなかった。
- トレプロスチニルを含むPAHに対する治療薬との因果関係を評価した。
- ※クロスオーバー患者はトレプロスチニルを開始する前までの事象を含めた。
- 用語辞書:MedDRA/J Ver. 24.0
クロスオーバー患者における呼吸器関連副作用の発現率は33.3%(25/75例)であった。
主な副作用は咳嗽14例(18.7%)、口腔咽頭痛7例(9.3%)、鼻出血4例(5.3%)であった。
死亡に至った呼吸器関連副作用は認められなかった。
- 当該論文及び導入元より提供された資料には、クロスオーバー患者における
重篤な呼吸器関連副作用及び投与中止に至った呼吸器関連副作用の記載が認められなかった。
- ※クロスオーバー患者はトレプロスチニルを開始する前までの事象を含めた。
- 用語辞書:MedDRA/J Ver. 24.0
6. 用法及び用量(抜粋)
〈肺動脈性肺高血圧症〉
通常、成人には、1日4回ネブライザを用いて吸入投与する。1回3吸入(トレプロスチニルとして18μg)から投与を開始し、忍容性を確認しながら、7日以上の間隔で、1回3吸入ずつ、最大9吸入(トレプロスチニルとして54μg)まで漸増する。3吸入の増量に対して忍容性に懸念がある場合は、増量幅を1又は2吸入としてもよい。忍容性がない場合は減量し、1回最小量は1吸入とすること。
2025年11月作成
17050-14/N6 60 GMJ