- 医療関係者向けホーム
- 循環器領域
- トレプロスト®吸入液
- Clinical Study(間質性肺疾患に伴う肺高血圧症):海外第Ⅱ/Ⅲ相試験 安全性
 Clinical Study海外第Ⅱ/Ⅲ相試験(間質性肺疾患に伴う肺高血圧症)
Clinical Study海外第Ⅱ/Ⅲ相試験(間質性肺疾患に伴う肺高血圧症)
安全性
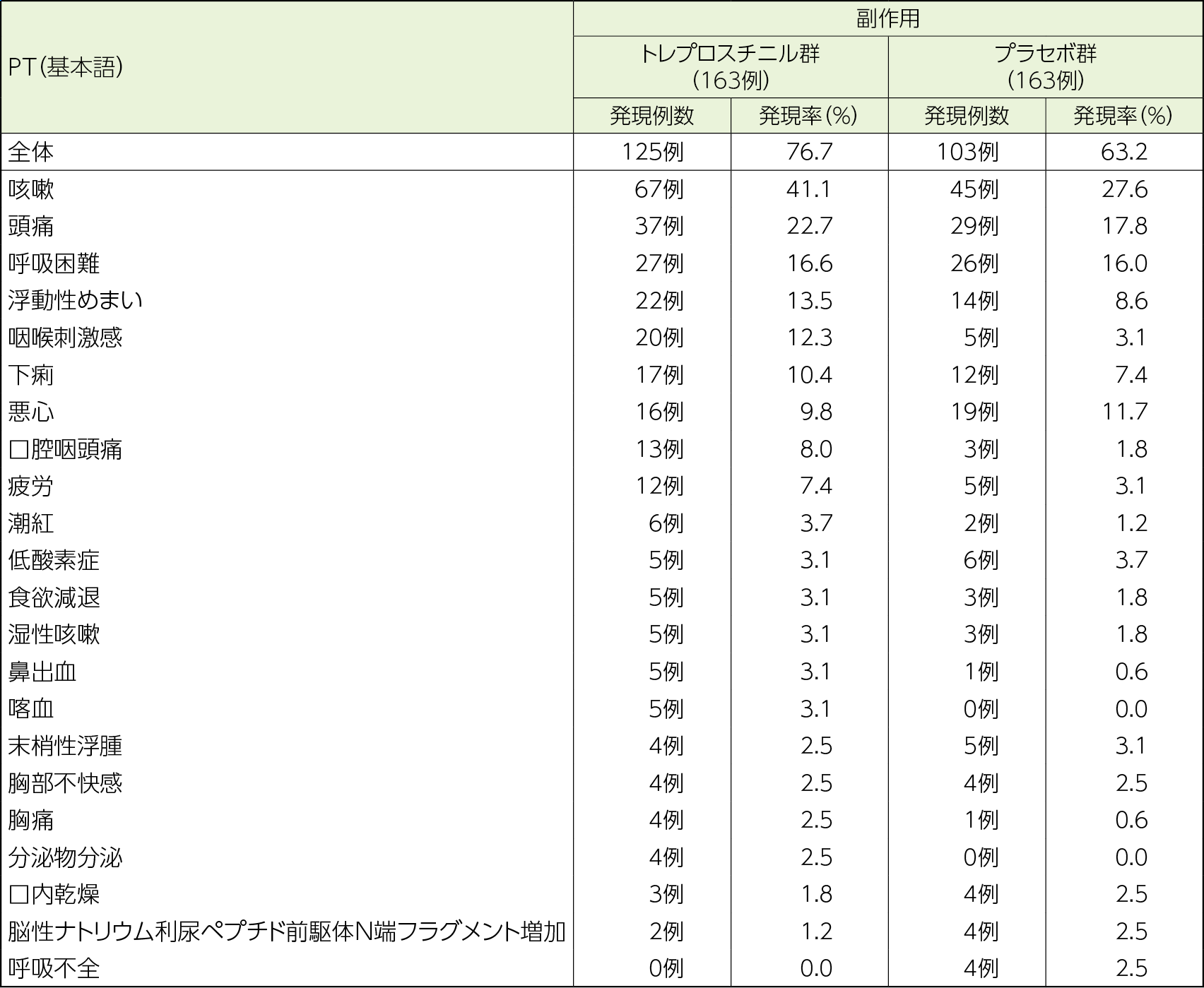
副作用
副作用はトレプロスチニル群で76.7%(125/163例)、プラセボ群で63.2%(103/163例)に認められた。
主な副作用はトレプロスチニル群で咳嗽67例(41.1%)、頭痛37例(22.7%)、呼吸困難27例(16.6%)、浮動性めまい22例(13.5%)、咽喉刺激感20例(12.3%)、下痢17例(10.4%)であった。
重篤な副作用はトレプロスチニル群で13例、プラセボ群で10例であり、トレプロスチニル群の主な重篤な副作用は急性呼吸不全、死亡(各2例)であった。
投与中止に至った副作用はトレプロスチニル群で23例、プラセボ群で12例に認められ、トレプロスチニル群の主な投与中止に至った副作用は呼吸困難(7例)、咳嗽(6例)であった。
死亡に至った副作用はトレプロスチニル群で4例、プラセボ群で1例に認められ、トレプロスチニル群の死亡に至った副作用は死亡※(2例)、急性心筋梗塞、特発性肺線維症(各1例)であった。
- ※PTを死亡として集計されたが死因は不明
- 用語辞書:MedDRA/J Ver.26.0
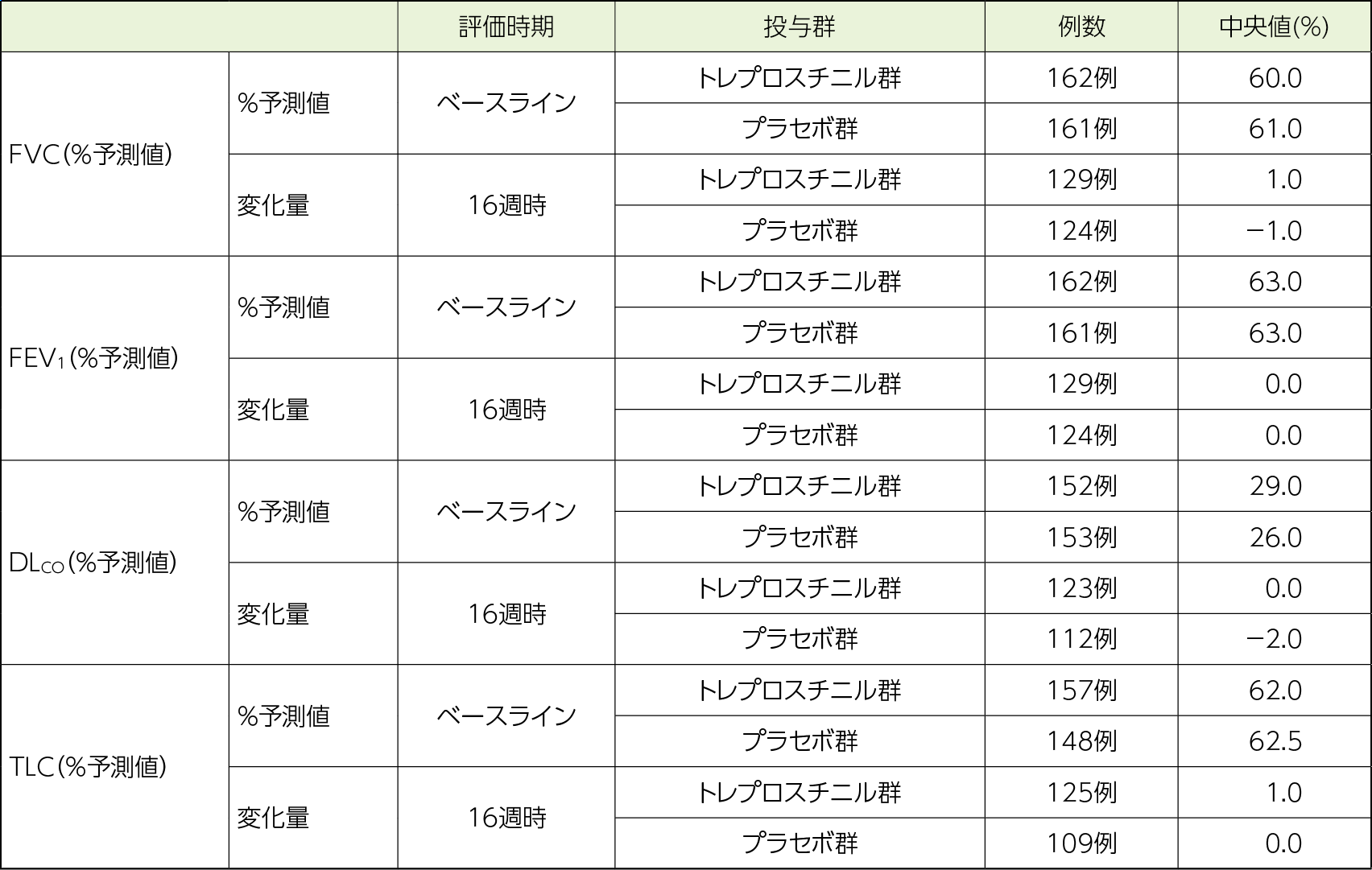
呼吸機能検査
FVC(%予測値)について、16週時におけるベースラインからの変化量の中央値は、トレプロスチニル群及びプラセボ群(以下同順)で1.0%及び−1.0%であった。
その他の呼吸機能検査パラメータについて、16週時におけるベースラインからの変化量の中央値は、FEV1(%予測値)で0.0%及び0.0%、DLCO(%予測値)で0.0%及び−2.0%、TLC(%予測値)で1.0%及び0.0%であった。
6. 用法及び用量(抜粋)
〈間質性肺疾患に伴う肺高血圧症〉
通常、成人には、1日4回ネブライザを用いて吸入投与する。1回3吸入(トレプロスチニルとして18μg)から投与を開始し、忍容性を確認しながら、3日以上の間隔で、1回1吸入ずつ、最大12吸入(トレプロスチニルとして72μg)まで漸増する。忍容性がない場合は減量し、1回最小量は1吸入とすること。
2025年11月作成
17050-14/N6 60 GMJ