- 医療関係者向けホーム
- 循環器領域
- トレプロスト®注射液
- Clinical Study:長期投与試験 安全性
 Clinical Study長期投与試験
Clinical Study長期投与試験
安全性
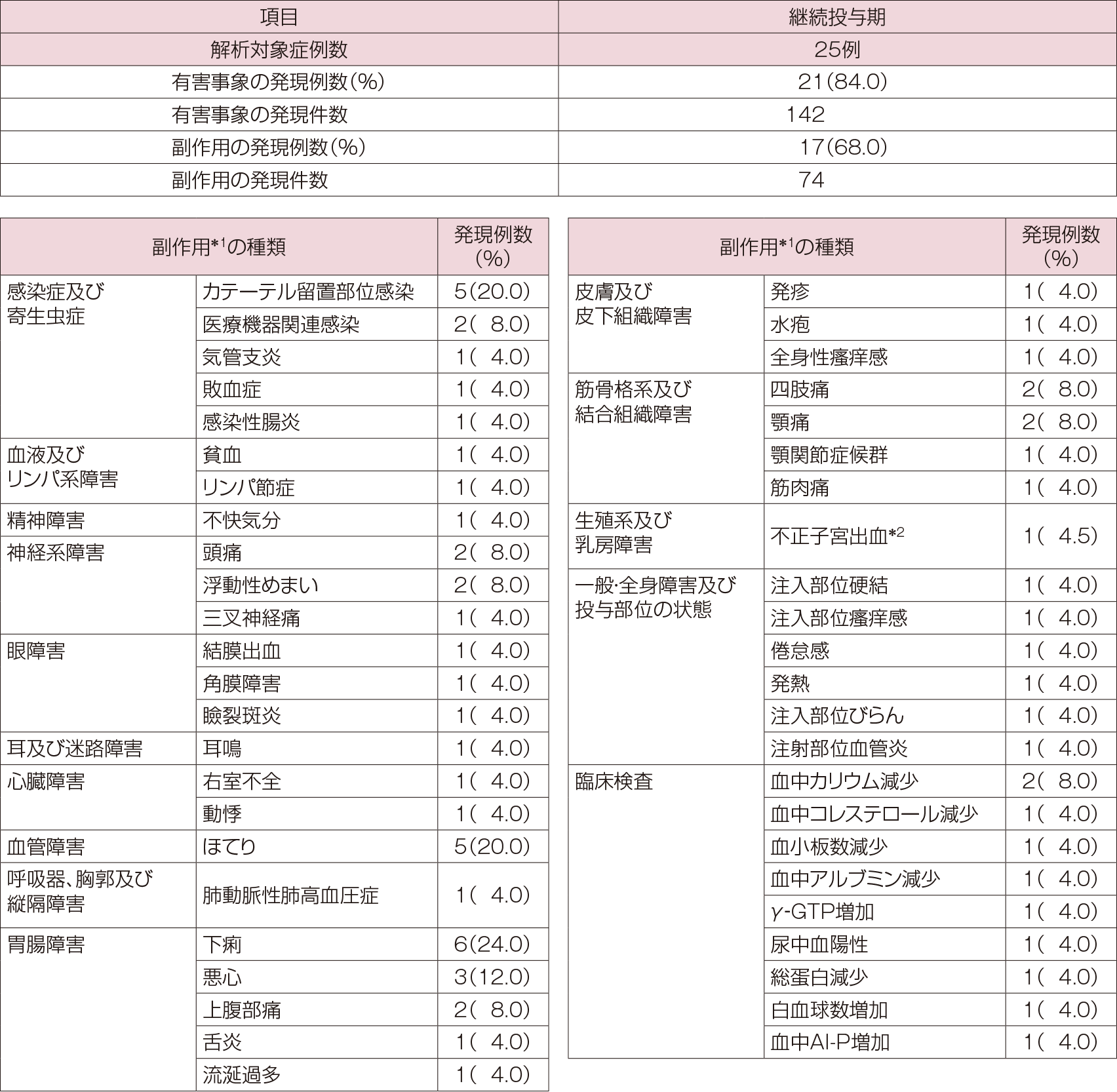
継続投与期(12週から36週まで)における有害事象は、84.0%(21/25例、142件)に認められた。副作用は、68.0%(17/25例、74件)に認められた。主な副作用(2例以上)は、下痢24.0%(6例)、カテーテル留置部位感染、ほてり各20.0%(5例)、悪心12.0%(3例)、医療機器関連感染、頭痛、浮動性めまい、上腹部痛、四肢痛、顎痛、血中カリウム減少各8.0%(2例)であった。重篤な副作用は16.0%(4/25例)に認められた。重篤な副作用の内訳は、医療機器関連感染8.0%(2例)、敗血症及び発熱各4%(1例)であった。
中止に至った副作用は認められなかった。
死亡に至った副作用は認められなかった。
- *1:副作用名はMedDRA/J ver15.0に基づき、器官別大分類に分類し、基本語を記載
- *2:女性(22例)での発現率