- 医療関係者向けホーム
- 循環器領域
- ユリス®錠
- Clinical Study:第Ⅲ相試験(ベンズブロマロン対照非劣性試験) 安全性
 Clinical Study第Ⅲ相試験(ベンズブロマロン対照非劣性試験)
Clinical Study第Ⅲ相試験(ベンズブロマロン対照非劣性試験)
安全性
痛風関節炎を除く副作用発現状況(SP解析対象)注)
痛風関節炎を除く副作用(臨床検査値異常を含む)は、ドチヌラド群で7/102例(6.9%)、ベンズブロマロン群で11/99例(11.1%)に認められた。2例以上に発現した副作用は、ドチヌラド群で関節炎が3/102例(2.9%)、ベンズブロマロン群でアラニンアミノトランスフェラーゼ増加及びアスパラギン酸アミノトランスフェラーゼ増加がそれぞれ2/99例(2.0%)に認められた。本試験において、両群ともに死亡例を含む重篤な副作用は認められなかった。本試験において投与中止に至った痛風関節炎以外の副作用は、ドチヌラド群で滑液包炎が1例に認められ、ベンズブロマロン群では認められなかった。
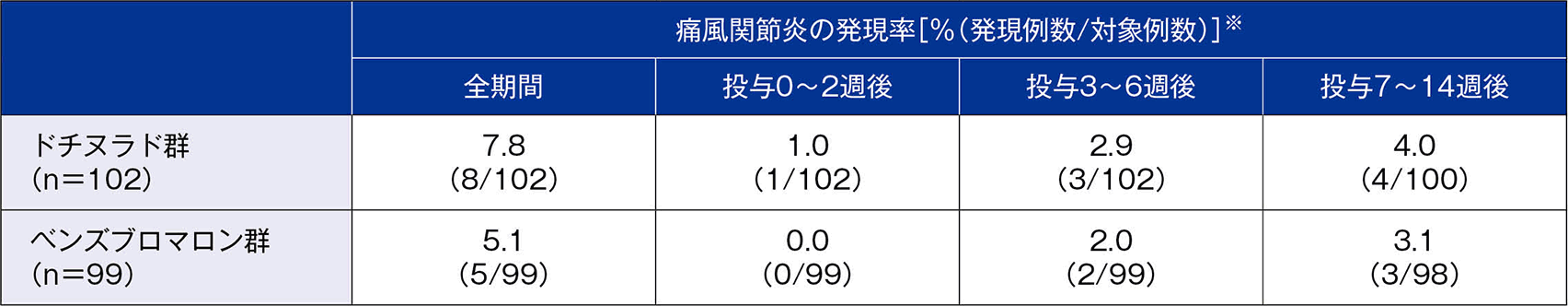
痛風関節炎(SP解析対象)注)
痛風関節炎の副作用は、ドチヌラド群で8/102例(7.8%)、ベンズブロマロン群で5/99例(5.1%)に認められた。本試験において投与中止に至った痛風関節炎の副作用は、ドチヌラド群で1例に認められ、ベンズブロマロン群では認められなかった。
投与群ごとの痛風関節炎の時期別発現率は下表のとおりであった。
- ※:各期間で症例の重複あり
- 注)本薬の薬理効果により血清尿酸値の急激な変動に伴い痛風関節炎が誘発される可能性があることから、痛風関節炎に関しては他の有害事象と別集計とした。