- 医療関係者向けホーム
- 消化器領域
- コレチメント®錠
- Clinical Study:CORE Ⅰ・Ⅱ試験併合解析 (海外第Ⅲ相試験併合解析) 海外データ 安全性②
 Clinical StudyCORE Ⅰ・Ⅱ試験併合解析 (海外第Ⅲ相試験併合解析)
Clinical StudyCORE Ⅰ・Ⅱ試験併合解析 (海外第Ⅲ相試験併合解析)
海外データ
安全性②
安全性評価項目糖質コルチコイド作用
投与後8週時/試験終了時にみられた糖質コルチコイド作用の発現状況は、下表の通りでした。
糖質コルチコイド作用〔併合安全性解析対象集団〕
- MedDRA/J Version 23.0
- 例数(%)
- 参照①:pH依存型メサラジン放出調節製剤2400mg/日
- 参照②:ブデソニド腸溶性顆粒充填カプセル9mg/日(本邦適応外)注)
- 社内資料:海外第Ⅲ相試験併合解析(2023年6月26日承認、CTD 2.7.3、2.7.4) 〈承認時評価資料〉
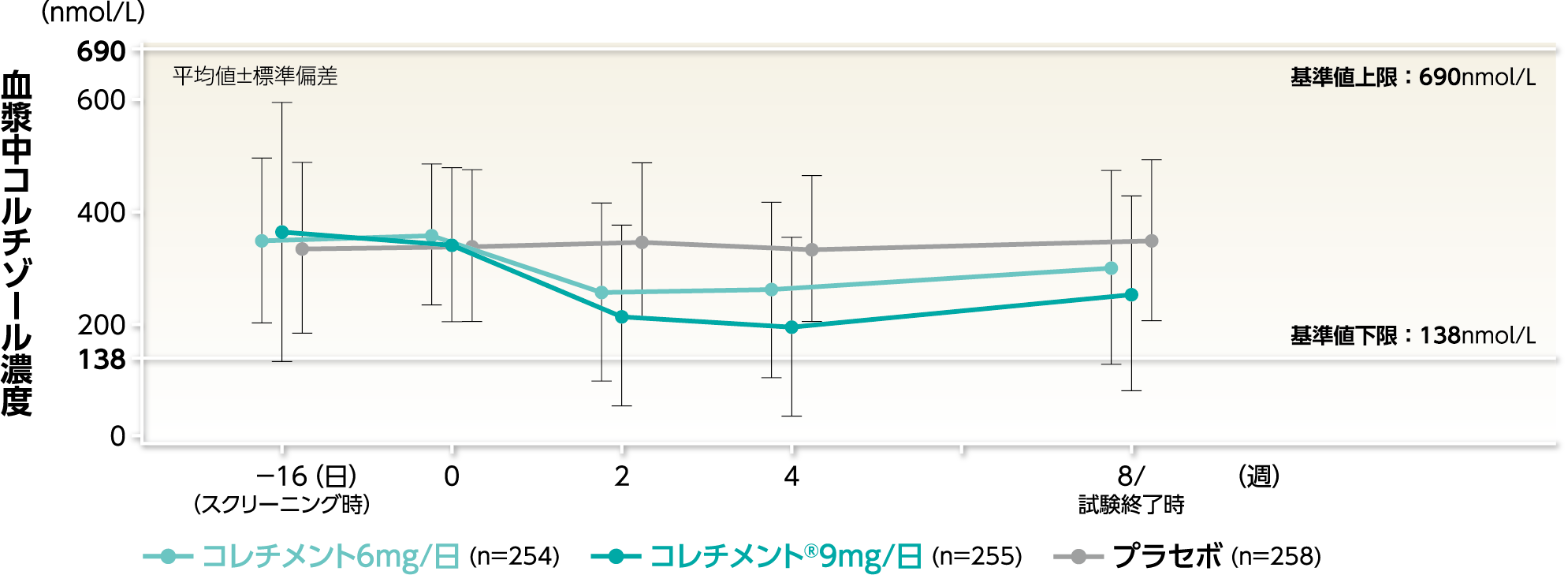
安全性評価項目臨床薬理血漿中コルチゾール濃度に及ぼす影響 参考情報
投与後8週時(または試験終了時)において、血漿中コルチゾール濃度の平均値は、プラセボ群の347.5nmol/Lに対し、コレチメント®9mg/日群では253.5nmol/Lでした。投与後8週時の血漿中コルチゾール濃度の平均値は、いずれの投与群も基準値内(基準値:138~690nmol/L)でした。
血漿中コルチゾール濃度の推移〔併合安全性解析対象集団〕
- 社内資料:海外第Ⅲ相試験併合解析(2023年6月26日承認、CTD 2.7.3、2.7.4) 〈承認時評価資料〉
●コレチメント®の【4. 効能又は効果】活動期潰瘍性大腸炎(重症を除く)
【6. 用法及び用量】通常、成人にはブデソニドとして9mgを1日1回朝経口投与する。
- 【8. 重要な基本的注意】(抜粋)
- 8.1.1 本剤を長期間投与した場合に、全身性の副作用があらわれる可能性があるため、漫然と投与しないこと。[7. 参照]
- ●pH依存型メサラジン放出調節製剤の【6. 用法及び用量】
- 通常、成人にはメサラジンとして1日2,400mgを3回に分けて食後経口投与するが、寛解期には、必要に応じて1日1回2,400mg食後経口投与とすることができる。活動期には、1日3,600mgを3回に分けて食後経口投与する。
なお、患者の状態により適宜減量する。
注)ブデソニド腸溶性顆粒充填カプセルは、潰瘍性大腸炎治療剤としては本邦適応外です。ブデソニド腸溶性顆粒充填カプセルの【効能又は効果】は下記の通りです。
【4. 効能又は効果】軽症から中等症の活動期クローン病
2024年9月作成
17309-6/N4 B2 MDC