- 医療関係者向けホーム
- 精神科領域
- レクサプロ
- Clinical Study:第Ⅲ相パロキセチン対照二重盲検比較試験(海外データ)(うつ病・うつ状態) 安全性
 Clinical Study第Ⅲ相パロキセチン対照二重盲検比較試験(海外データ)(うつ病・うつ状態)
Clinical Study第Ⅲ相パロキセチン対照二重盲検比較試験(海外データ)(うつ病・うつ状態)
安全性
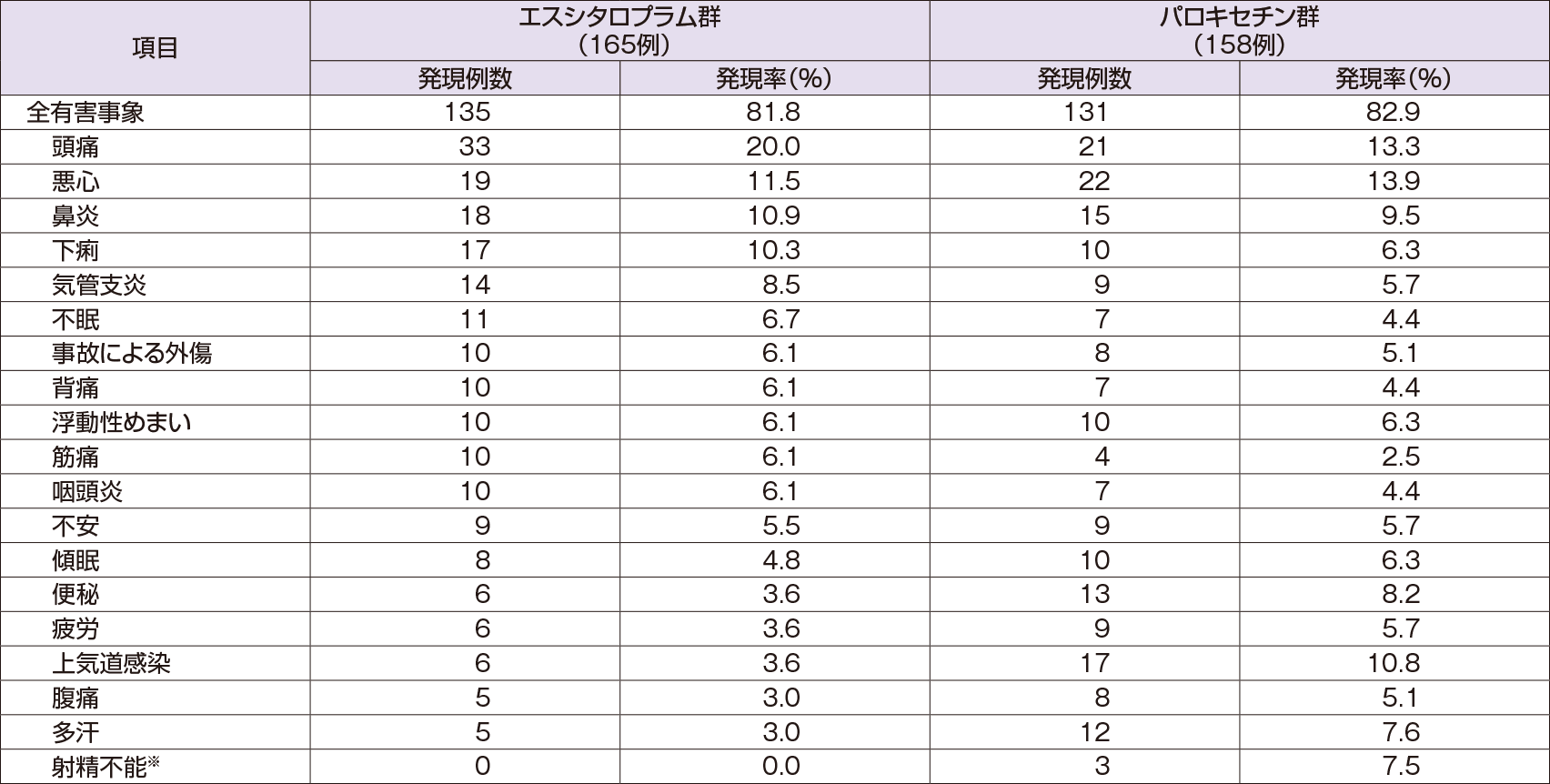
有害事象
全有害事象は、エスシタロプラム群165例中135例(81.8%)、パロキセチン群158例中131例(82.9%)に認められた。いずれかの群で5%以上発現した有害事象は下表の通りであった。重篤な有害事象として、エスシタロプラム群で1例(0.7%)、パロキセチン群で4例(3.1%)に自殺企図が認められた。
- ※:男性のみの母数を用いた
投与中止
投与中の中止例は、エスシタロプラム群165例中35例(21.2%)、パロキセチン群158例中54例(34.2%)にみられた。そのうち、有害事象による中止例は、それぞれ15例(9.1%)及び18例(11.4%)であった。また、効果不十分による中止は、それぞれ6例(3.6%)及び16例(10.1%)であった。
DESSによる離脱症状の評価
後観察期開始時から後観察期の隔日投与終了時におけるmodified DESS 47合計点の変化量(平均値)は、エスシタロプラム群−0.02、パロキセチン群1.28であった。また、後観察期のプラセボ投与1週時では、エスシタロプラム群1.63、パロキセチン群3.42であった。
- 平均値
- † ITT(Intent-to-treat):割付されたグループのまま集計、評価、解析されること、又はそのような解析集団
- †† OC(Observed Cases):欠測値を他の値で補うことなく実測の値のみを用いて解析する方法