- 医療関係者向けホーム
- 精神科領域
- レクサプロ
- Clinical Study:第Ⅲ相プラセボ対照二重盲検再燃予防試験(海外データ)(社会不安障害) 試験の概要
 Clinical Study第Ⅲ相プラセボ対照二重盲検再燃予防試験(海外データ)(社会不安障害)
Clinical Study第Ⅲ相プラセボ対照二重盲検再燃予防試験(海外データ)(社会不安障害)
「禁忌を含む使用上の注意」等は添付文書をご参照ください。
試験の概要「第Ⅲ相プラセボ対照二重盲検再燃予防試験(海外データ)(社会不安障害)」
- Montgomery,S. A. et al.: J Clin Psychiatry 66:1270-1278(2005)
- 【試験実施体制:GCP(Good Clinical Practice)に準拠し、ルンドベック社の支援(出資、労務提供、共著者の一部)により実施】
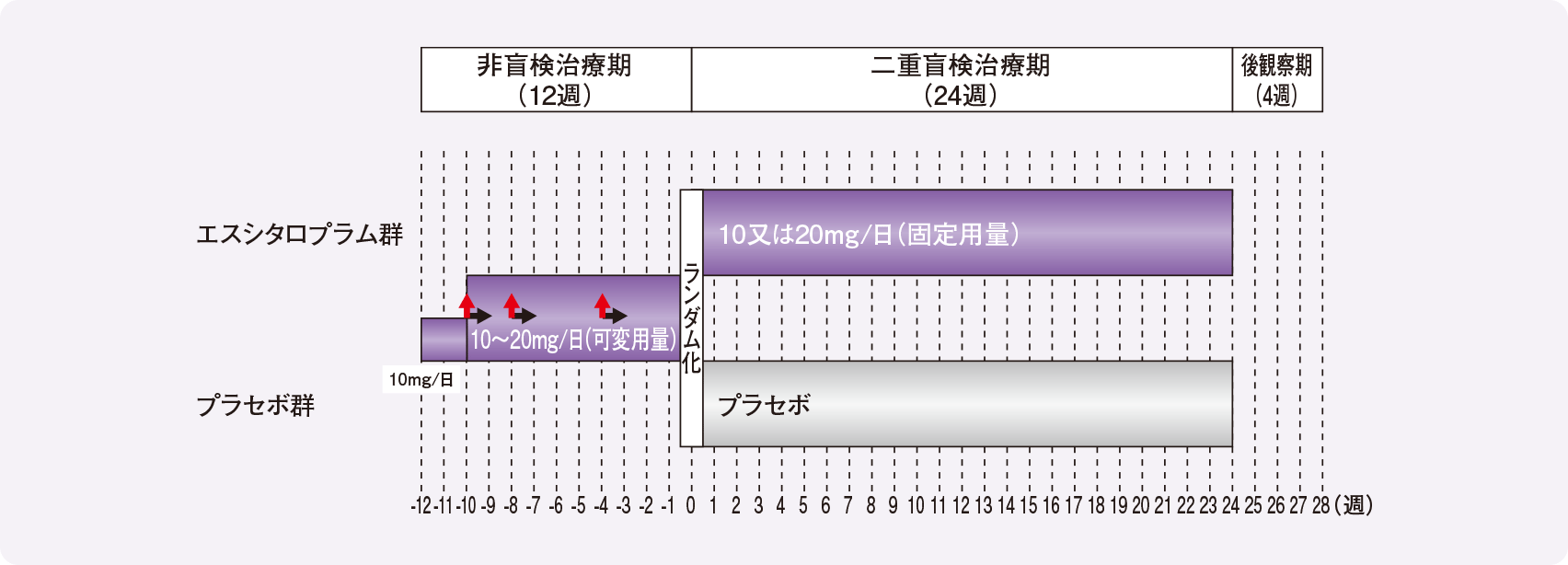
試験デザイン
ランダム化、二重盲検並行群間比較試験
目的
社会不安障害患者を対象にエスシタロプラム10mg/日又は20mg/日の再燃予防効果及び安全性について、プラセボを対照に検討した。
対象
DSM-IVによる主診断が社会不安障害で、かつ全般性社会不安障害に該当する患者で、LSAS合計点が70点以上、LSASにおいて恐怖感/不安感もしくは回避行動を示す対象となる社会状況が4項目以上あり、SDSサブスケールのうち1つ以上が5点以上である18歳以上80歳以下の外来患者(解析対象:517例)
投与方法
-
非盲検治療期:全例にエスシタロプラム10mgを2週間投与後、適宜増減により10~20mg/日を10週間投与
-
二重盲検治療期:
- 非盲検治療期終了時にCGI-Iが1又は2(反応)であった症例を下記2群に割付けて24週間投与
- エスシタロプラム群(190例):非盲検治療期終了時の投与量を継続
- プラセボ群(181例):プラセボを投与
有効性評価項目
<主要評価項目>
二重盲検治療期における再燃(LSAS合計点がランダム化から10点以上増加、もしくは効果不十分による中止)までの期間
<副次評価項目>
LSAS合計点の変化量、LSAS恐怖感/不安感、回避サブスケール合計点の変化量、SDSスコア
安全性評価項目
有害事象、DESS 等
解析計画
主要評価項目である二重盲検治療期における再燃までの期間については、Log-rank検定を用いて再燃した患者数と再燃までの期間を考慮して投与群間の比較を行う。
補足として、カプランマイヤー曲線やCox比例ハザードモデルの生存データは、再燃率の比較等に使用する。