- 医療関係者向けホーム
- 精神科領域
- レクサプロ
- Clinical Study:第Ⅲ相プラセボ対照二重盲検再発予防試験(海外データ)(うつ病・うつ状態) 試験の概要
 Clinical Study第Ⅲ相プラセボ対照二重盲検再発予防試験(海外データ)(うつ病・うつ状態)
Clinical Study第Ⅲ相プラセボ対照二重盲検再発予防試験(海外データ)(うつ病・うつ状態)
「禁忌を含む使用上の注意」等は添付文書をご参照ください。
試験の概要「第Ⅲ相プラセボ対照二重盲検再発予防試験(海外データ)(うつ病・うつ状態)」
- Kornstein, S. G. et al.:J Clin Psychiatry 67, 1767-1775(2006)
【試験実施体制:三菱東京製薬株式会社(現:田辺三菱製薬株式会社)の支援(共著者の一部への研究支援)により実施】
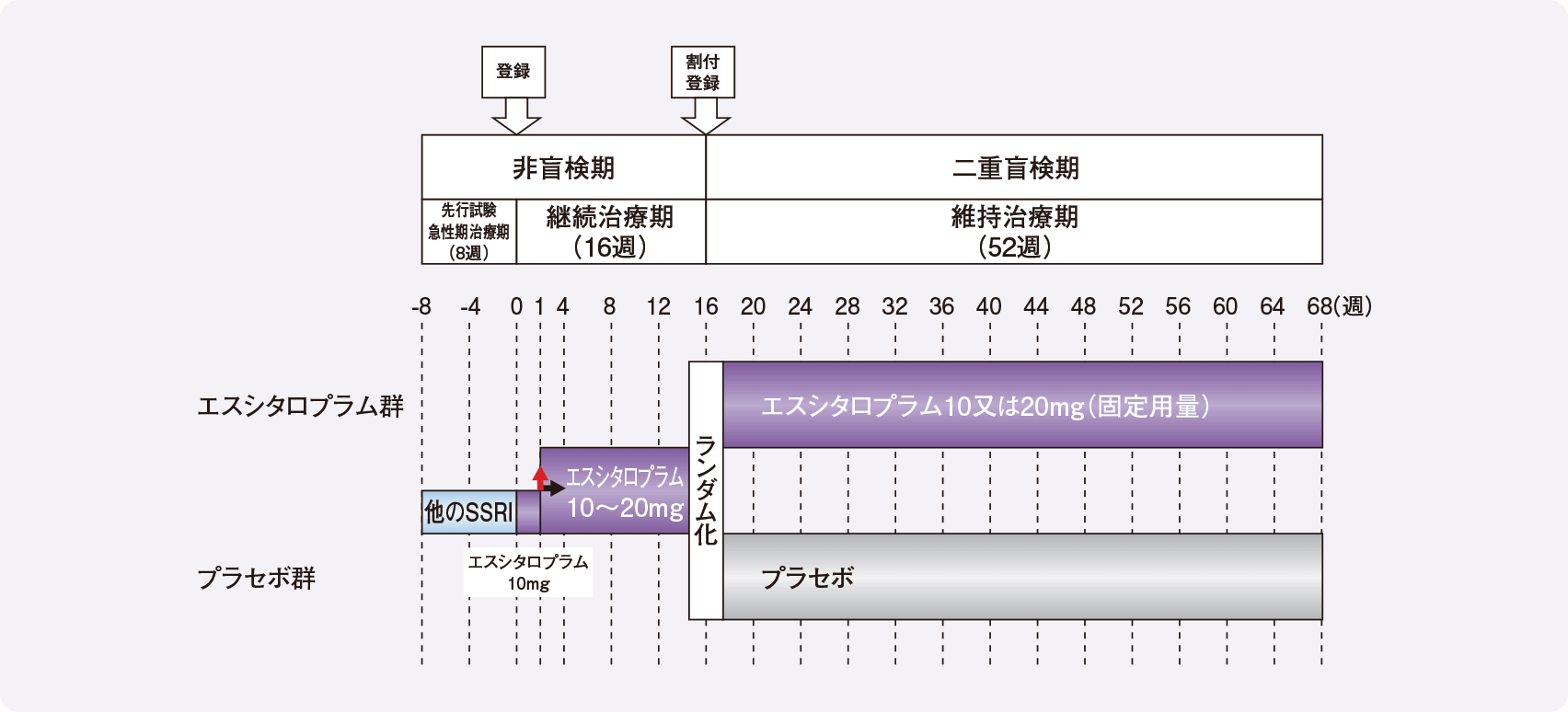
試験デザイン
ランダム化、二重盲検並行群間比較試験
目的
大うつ病性障害患者を対象に行われた他のSSRI※による先行試験にて寛解が得られた症例234例において、エスシタロプラム10mg/日又は20mg/日の再発予防効果及び安全性について、プラセボを対照として検討した。
- ※他のSSRI:シタロプラム、フルオキセチン(いずれも国内未発売)、セルトラリン、パロキセチン
対象
DSM-IVによる主診断が大うつ病性障害であり、先行試験終了時においてMADRS合計点が12点以下(寛解)の18歳以上の患者
投与方法
-
継続治療期:エスシタロプラム10mg/日を1週間投与後、適宜増減により10mg/日又は20mg/日を15週間投与
-
維持治療期:
- 継続治療期終了時にMADRS合計点が12点以下(寛解)を維持した症例を下記2群に割付けて52週間投与
- エスシタロプラム群(73例):継続治療期16週時の投与量を継続
- プラセボ群(66例):プラセボを投与
有効性評価項目
<主要評価項目>維持治療期における再発(MADRS合計点が22点以上、もしくは効果不十分による中止)までの期間
<その他の評価項目>維持治療期における再発率(MADRS合計点が22点以上、もしくは効果不十分によって中止した患者の割合)、MADRS合計点の変化量 等
安全性評価項目
維持治療期に発現した有害事象の発現率、投与中止率 等
解析計画
主要評価項目である維持治療期における再発までの期間については、Cox比例ハザードモデルを用いて投与群及びベースラインのMADRS合計点を説明変数として、投与群間の比較を行う。