- 医療関係者向けホーム
- 精神科領域
- レクサプロ
- Clinical Study:第Ⅲ相プラセボ対照二重盲検比較試験(社会不安障害) 試験の概要
 Clinical Study第Ⅲ相プラセボ対照二重盲検比較試験(社会不安障害)
Clinical Study第Ⅲ相プラセボ対照二重盲検比較試験(社会不安障害)
「禁忌を含む使用上の注意」等は添付文書をご参照ください。
試験の概要「第Ⅲ相プラセボ対照二重盲検比較試験(社会不安障害)」
- 持田製薬社内資料 : 社会不安障害に対するプラセボ対照試験(2015年11月20日承認、CTD 2.7.6.1.1)<承認時評価資料>
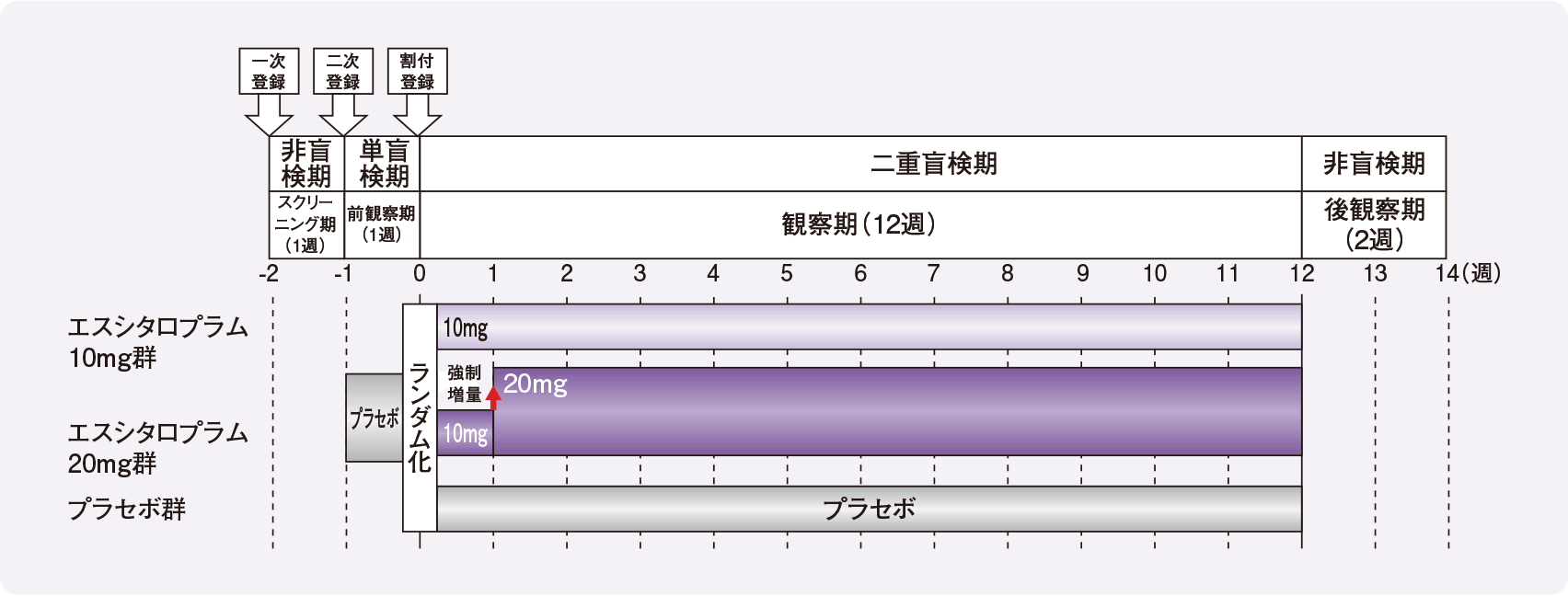
試験デザイン
ランダム化、二重盲検並行群間比較試験
目的
社会不安障害患者※を対象にエスシタロプラム10mg/日及び20mg/日の有効性(プラセボに対する優越性)と安全性を検討した。
対象
DSM-IV-TRによる主診断が社会不安障害で、かつ全般性社会不安障害に該当する患者で、LSAS-J合計点が60点以上、CGI-Sが4点以上、LSAS-Jにおいて恐怖感/不安感もしくは回避行動を示す対象となる状況が4項目以上あり、そのうち2項目以上が社交状況である18歳以上65歳未満の外来患者
投与方法
- 前観察期:全例にプラセボを1週間投与
-
観察期:
- エスシタロプラム10mg群(198例):エスシタロプラム10mg/日を12週間投与
- エスシタロプラム20mg群(193例):エスシタロプラム10mg/日を1週間投与後、20mg/日を11週間投与
- プラセボ群(196例):プラセボを12週間投与
有効性評価項目
<主要評価項目>
LSAS-J合計点の変化量(12週時)
<副次評価項目>
12週時における以下の項目
- LSAS-J合計点での反応率(合計点がベースラインから30%以上減少した患者を反応有とした)
- LSAS-J恐怖感/不安感サブスケール合計点の変化量
- LSAS-J回避サブスケール合計点の変化量
- CGI-Sの変化量
- CGI-I
- CGI-Iでの反応率(CGI-Iが「著明改善」又は「中等度改善」を示した患者を反応有とした)
安全性評価項目
副作用発現率 等
解析計画
主要評価項目であるLSAS-J合計点の変化量(12週時、LOCF†)については、ANCOVAを用いて投与群を因子、ベースラインのLSAS-J合計点を共変量として投与群間の比較を行う。なお、エスシタロプラム10mg群においてプラセボ群に対する優越性が検証された場合に限りエスシタロプラム20mg群とプラセボ群の比較を行う。あわせてLSAS-J合計点の変化量の推移(LOCF)を解析する。また、感度分析として、LSAS-J合計点の変化量(12週時)についてOC††及びMMRMによる解析を行い、LSAS-J合計点の変化量の推移(OC)を解析する。PMDAからの照会事項に従い、サブグループ解析としてLSAS-J合計点の変化量におけるベースラインの重症度別、SSRI又はSNRIによる治療歴の有無別、社会不安障害以外の精神障害の併存症の有無別の解析を行った。
- † LOCF(Last Observational Carried Forward):投与終了時の値が得られていない症例について、最終観察時点での測定値で代用する方法
- †† OC(Observed Cases):欠測値を他の値で補うことなく実測の値のみを用いて解析する方法
- ※社会不安障害:2008年に日本精神神経学会により社交不安障害と表記されることになったため、本試験は社交不安障害を対象として実施されましたが、効能又は効果にあわせて、社会不安障害と記載しています。