- 医療関係者向けホーム
- 循環器領域
- トレプロスト®注射液
- Clinical Study:国内第Ⅱ/Ⅲ相試験(エポプロステノールからの切替え例を対象とした試験:皮下投与又は静脈内投与試験) 安全性
 Clinical Study国内第Ⅱ/Ⅲ相試験(エポプロステノールからの切替え例を対象
Clinical Study国内第Ⅱ/Ⅲ相試験(エポプロステノールからの切替え例を対象
とした試験:皮下投与又は静脈内投与試験)
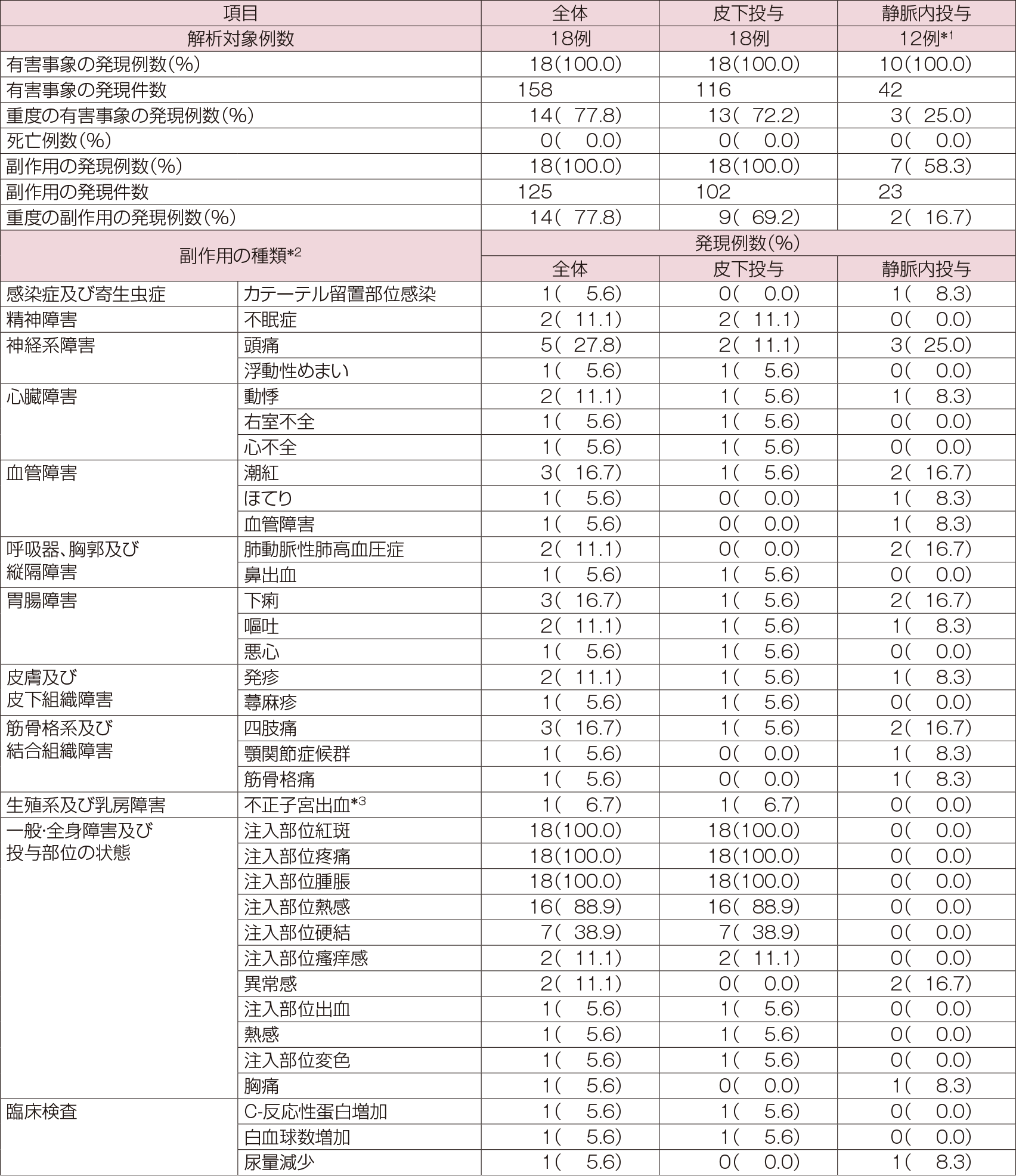
安全性
有害事象は、皮下投与で100.0%(18/18例、116件)、静脈内投与で83.3%(10/12例、42件)に認められた。死亡例は両投与経路ともに認められなかった。重度の有害事象の内訳は、皮下投与では注入部位疼痛(72.2%)、注入部位紅斑、注入部位腫脹(各5.6%)であり、静脈内投与では肺動脈性肺高血圧症(16.7%)、右室不全(8.3%)であった。重篤な有害事象は皮下投与では5.6%(1/18例)に咽頭炎および動悸(各1件)が認められた。静脈内投与では33.3%(4/12例)にカテーテル留置部位感染、外傷性気胸、骨壊死、右室不全、下痢、嘔吐(各1件)が認められた。副作用は、皮下投与で100.0%(18/18例、102件)、静脈内投与で58.3%(7/12例、23件)であった。中止に至った有害事象は、皮下投与で11.1%(2例)、静脈内投与で25.0%(3例)に認められた。中止理由は、皮下投与では肺動脈性肺高血圧症、注入部位紅斑、注入部位腫脹、注入部位熱感、注入部位疼痛各5.6%(1例)であった。静脈内投与では、肺動脈性肺高血圧症16.7%(2例)、右室不全8.3%(1例)であった。有害事象の概要及び副作用の詳細を以下に示す。
- *1:皮下投与開始例18例のうち、静脈内投与へ投与経路を変更した症例
- *2:副作用名はMedDRA/J ver15.0に基づき、器官別大分類に分類し、基本語を記載
- *3:女性(15例)での発現率