- 医療関係者向けホーム
- 消化器領域
- コレチメント®錠
- Information:アンテドラッグ型の経口ステロイド製剤
 Information
Information
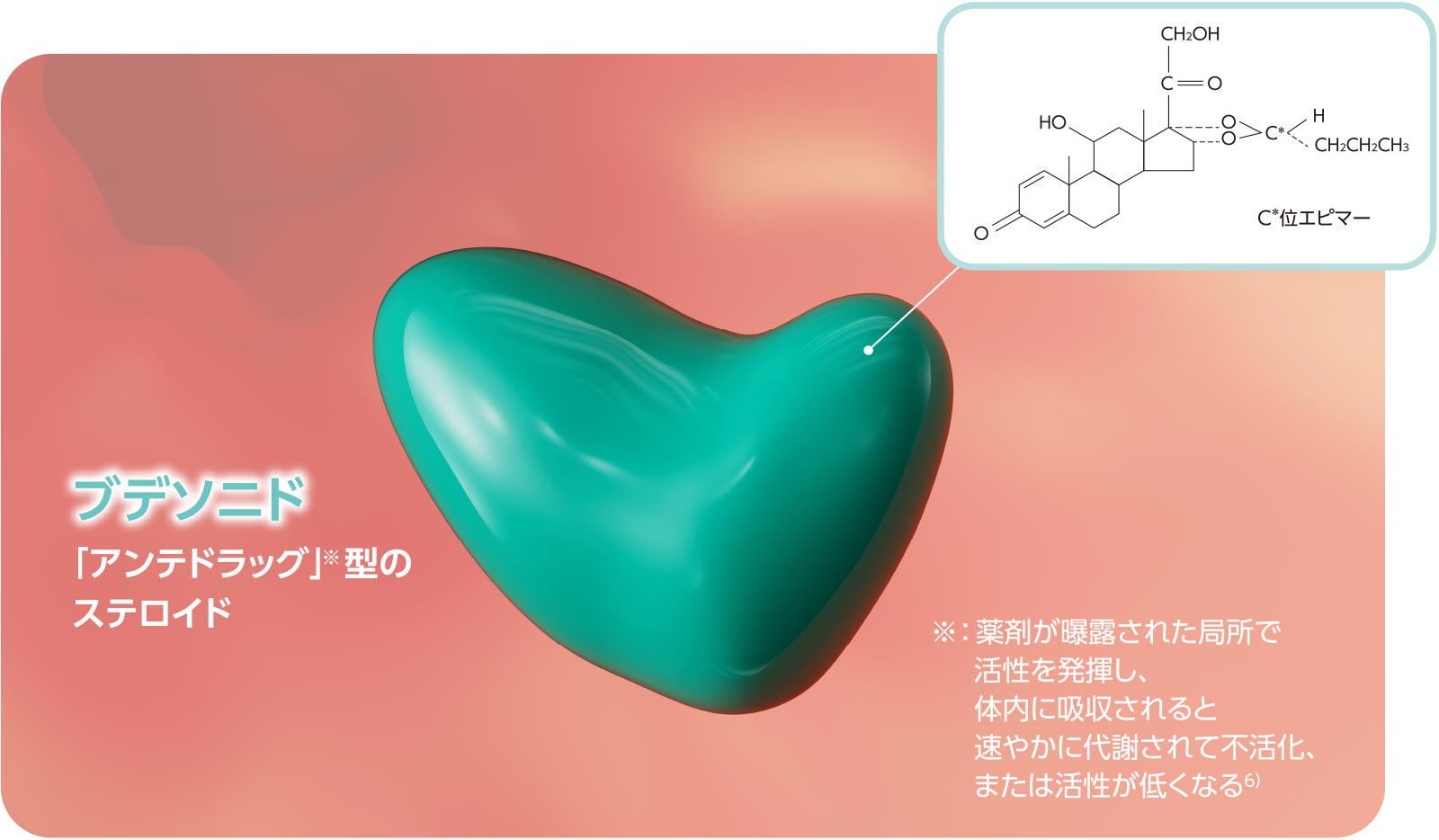
アンテドラッグ型の経口ステロイド製剤
コレチメント®の有効成分であるブデソニドは、「アンテドラッグ」※型の第二世代のステロイドであり、局所作用が期待されます
ブデソニドとは
- 第二世代のステロイド製剤1)
- 経口投与時の全身曝露量が低値であった2)、3)
ブデソニド腸溶性顆粒充填カプセル注)単回経口投与後のバイオアベイラビリティは、健康成人8例では9~12%〔外国人データ〕、クローン病患者6例では11~21%〔外国人データ〕 - 全身に曝露される糖質コルチコイド活性の軽減が期待される4)
主な代謝物の糖質コルチコイド活性は、未変化体の1%未満(ラット、in vitro) - 局所作用を発揮した後、体内に吸収されると速やかに代謝され、全身への影響の軽減が期待される「アンテドラッグ」※型のステロイド5)
- 1)Ko, C.W. et al.:Gastroenterology. 2019;156(3):748-764
- 2)Edsbäcker, S. et al.:Aliment. Pharmacol. Ther. 2003;17(4):525-536
- 3)Edsbäcker, S. et al.:Clin. Pharmacokinet. 2004;43(12):803-821
- 4)Dahlberg, E. et al.:Mol. Pharmacol. 1984;25(1):70-78
- 5)金城 福則.:新薬と臨牀. 2003;52(7):992-999
- 6)高橋 俊雄、橋田 充 編『今日のDDS・薬物送達システム』医薬ジャーナル社 1999 p32-33、p43、p46
【4. 効能又は効果】活動期潰瘍性大腸炎(重症を除く)
注)ブデソニド腸溶性顆粒充填カプセルは、潰瘍性大腸炎治療剤としては本邦適応外です。ブデソニド腸溶性顆粒充填カプセルの【効能又は効果】は下記の通りです。
【4. 効能又は効果】軽症から中等症の活動期クローン病
臨床薬理
(1)血漿中コルチゾール濃度に及ぼす影響1)、2)参考情報
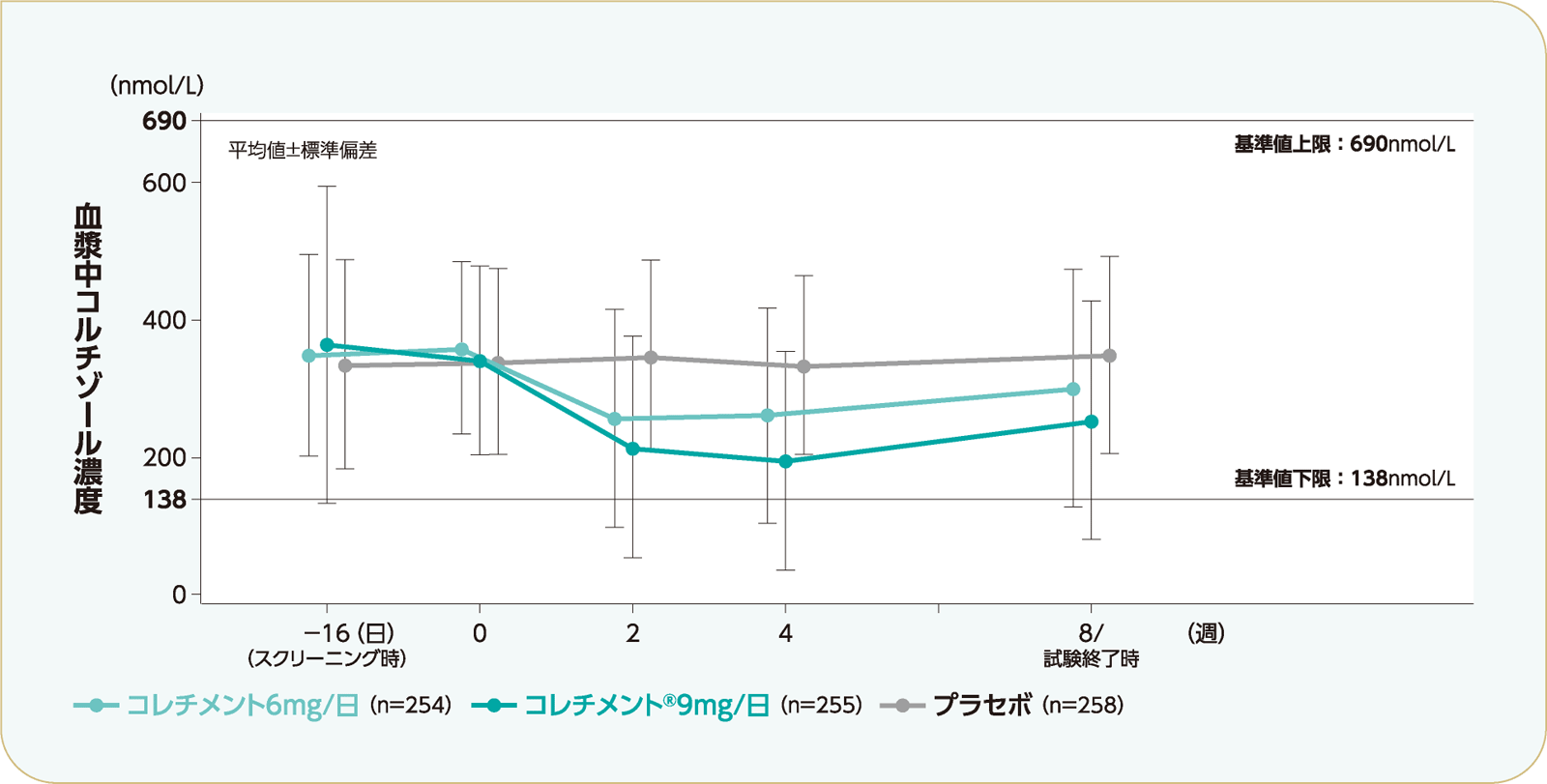
①海外第Ⅲ相試験併合解析(CORE I・Ⅱ試験併合解析)1)海外データ参考情報
投与後8週時(または試験終了時)において、血漿中コルチゾール濃度の平均値は、プラセボ群の347.5nmol/Lに対し、コレチメント6mg/日群では299.4nmol/L、コレチメント®9mg/日群では253.5nmol/Lでした。投与後8週時の血漿中コルチゾール濃度の平均値は、いずれの投与群も基準値内(基準値:138~690nmol/L)でした。
血漿中コルチゾール濃度の推移〔併合安全性解析対象集団〕
- ★海外第Ⅲ相試験併合解析(CORE I・Ⅱ試験併合解析)の試験概要はこちらをご参照ください。
- 1)社内資料:海外第Ⅲ相試験併合解析(2023年6月26日承認、CTD 2.7.3、2.7.4)〈承認時評価資料〉
- 対象外国人の軽症~中等症の活動期潰瘍性大腸炎患者1,020例
[コレチメント6mg/日群254例、コレチメント®9mg/日群255例、プラセボ群258例、参照群①(pH依存型メサラジン放出調節製剤2400mg/日)127例、参照群②〔ブデソニド腸溶性顆粒充填カプセル9mg/日〈本邦適応外〉〕126例] - 方法コレチメント6mg/日、コレチメント®9mg/日またはプラセボを、1日1回朝食後に8週間投与した。
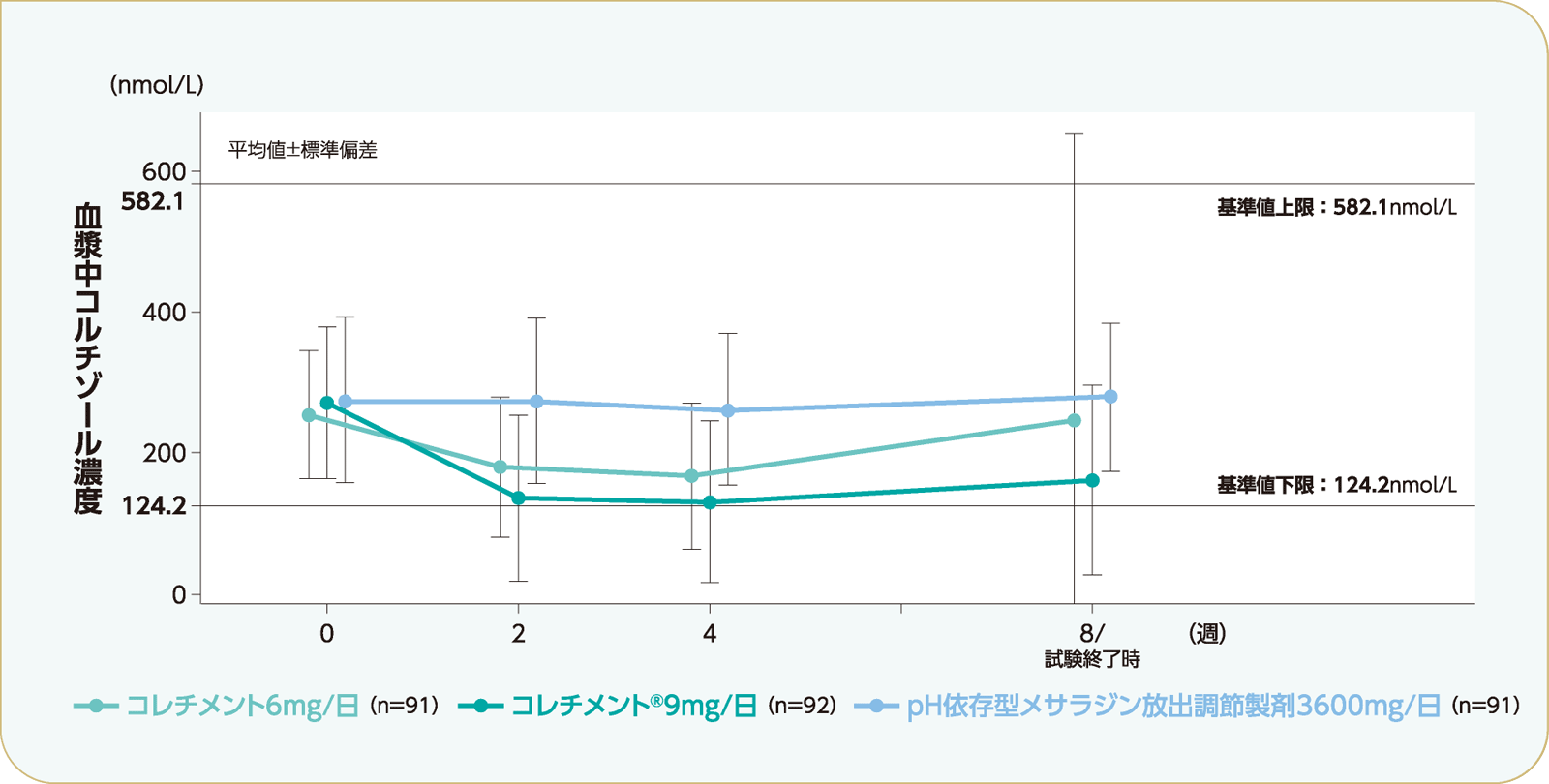
②国内第Ⅲ相試験2)参考情報
投与後8週時(または試験終了時)において、血漿中コルチゾール濃度の平均値はコレチメント6mg/日群では247.25nmol/L、コレチメント®9mg/日群では161.15nmol/L、pH依存型メサラジン放出調節製剤3600mg/日群では278.87nmol/Lでした。投与期間を通じて、血漿中コルチゾール濃度の平均値は、いずれの投与群も基準値内(基準値:124.2~582.1nmol/L)でした。
血漿中コルチゾール濃度の推移〔安全性解析対象集団〕
- ★国内第Ⅲ相試験の試験概要はこちらをご参照ください。
- 2)社内資料:国内第Ⅲ相試験(2023年6月26日承認、CTD 2.7.6.5)〈承認時評価資料〉
- 対象日本人の軽症~中等症の活動期潰瘍性大腸炎患者274例
- 方法コレチメント6mg/日(1日1回朝食後投与)、コレチメント®9mg/日(1日1回朝食後投与)、またはpH依存型メサラジン放出調節製剤3600mg/日(1日3回毎食後投与)を8週間投与した。
- 【5. 効能又は効果に関連する注意】
- 「17. 臨床成績」の項の内容を熟知し、メサラジン3,600mgを対照とした国内臨床試験で非劣性が検証されていないことを十分に理解した上で、本剤投与の適否を判断すること。[17.1.1、17.1.2 参照]
【6. 用法及び用量】通常、成人にはブデソニドとして9mgを1日1回朝経口投与する。
- 【8. 重要な基本的注意】(抜粋)
- 8.1.1 本剤を長期間投与した場合に、全身性の副作用があらわれる可能性があるため、漫然と投与しないこと。[7. 参照]
2024年9月作成
17309-6/N4 B2 MDC