- 医療関係者向けホーム
- 消化器領域
- オンボー®
- Clinical Study(潰瘍性大腸炎)「寛解導入期」に対する効果 日本人部分集団(サブグループ解析)
 Clinical Study(潰瘍性大腸炎)「寛解導入期」に対する効果
Clinical Study(潰瘍性大腸炎)「寛解導入期」に対する効果
日本人部分集団(サブグループ解析)
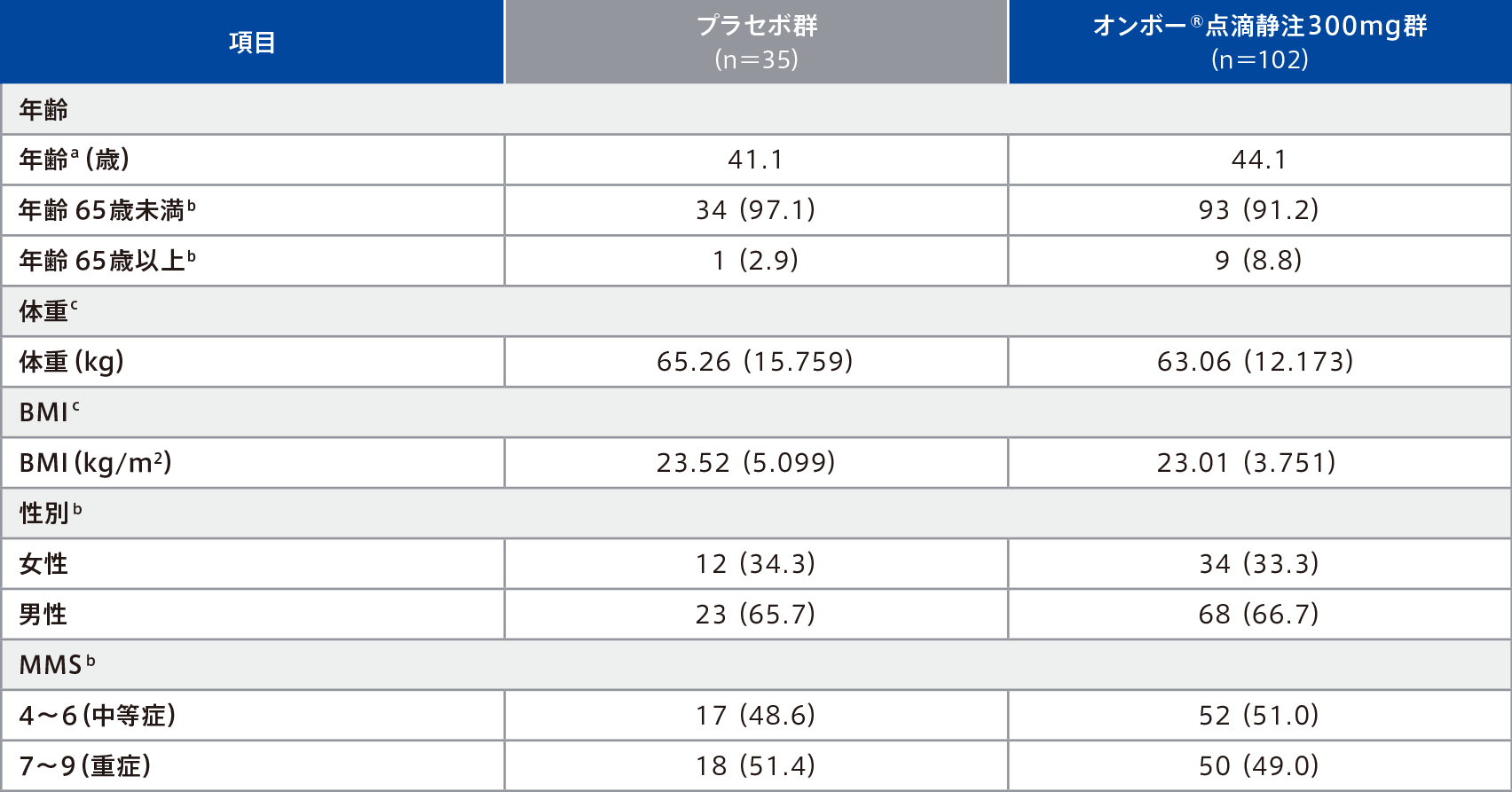
患者背景
有効性
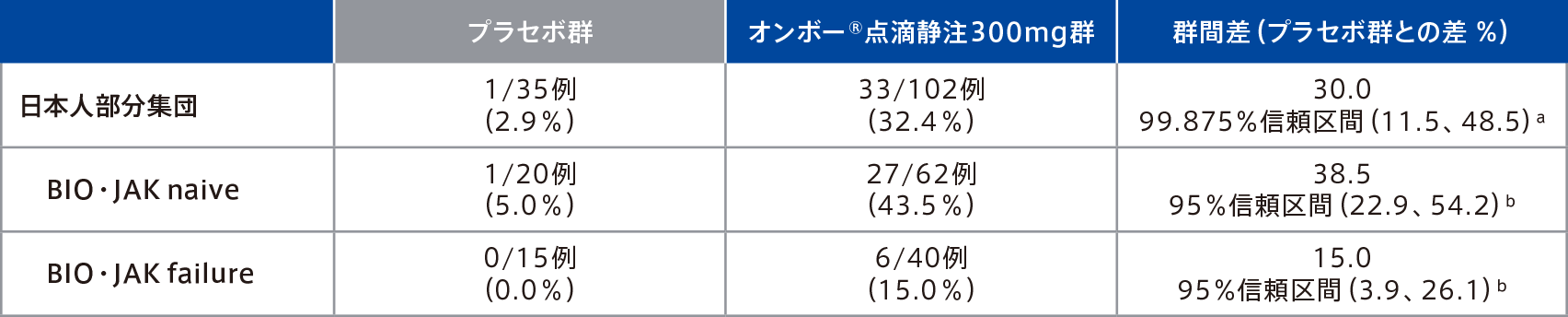
●12週時点で臨床的寛解を達成した患者の割合
(主要評価項目のサブグループ解析:日本人部分集団)
(日本人部分集団のサブグループ解析:BIO・JAK naive/BIO・JAK failure)
日本人部分集団における12週時点で臨床的寛解を達成した患者の割合は、オンボー®点滴静注300mg群32.4%(33/102例)、プラセボ群2.9%(1/35例)であった。
日本人部分集団のBIO・JAK naiveでは、12週時点で臨床的寛解を達成した患者の割合は、オンボー®点滴静注300mg群43.5%(27/62例)、プラセボ群5.0%(1/20例)、BIO・JAK failureでは、12週時点で臨床的寛解を達成した患者の割合は、オンボー®点滴静注300mg群15.0%(6/40例)、プラセボ群0.0%(0/15例)であった。
mITT、NRI
- a 生物学的製剤に対する治療反応性不良の状況(あり/なし)、ベースラインのステロイド系薬剤の使用(あり/なし)、ベースラインの疾患活動性(MMS 4~6/7~9)を調整因子としたCMH法
- b 正規近似法(連続修正なし)
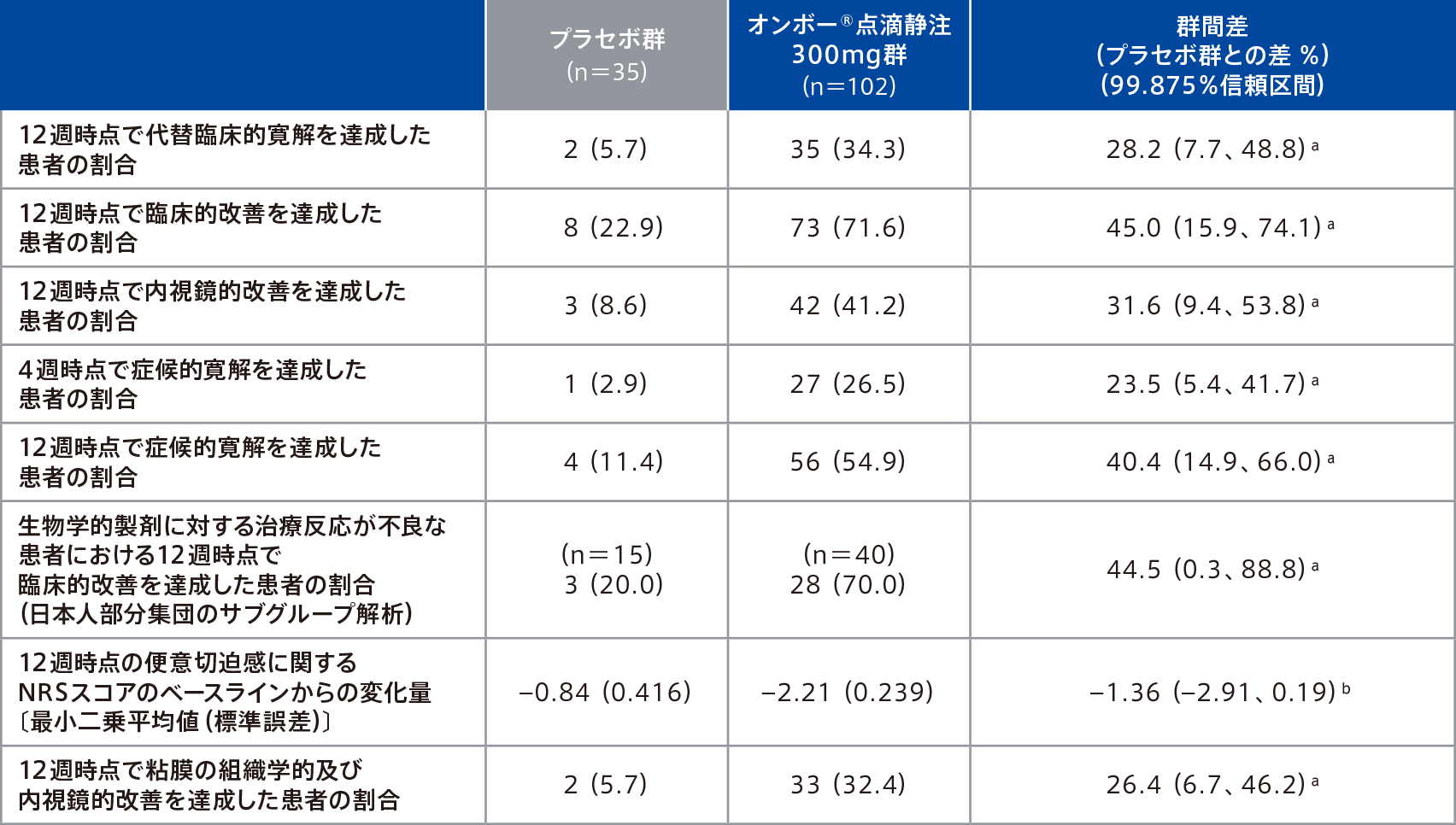
●重要な副次評価項目のサブグループ解析:日本人部分集団
日本人部分集団における重要な副次評価項目の結果は下表のとおりであった。
例数(%)、mITT、NRI(12週時点の便意切迫感に関するNRSスコアのベースラインからの変化量以外)
- a 生物学的製剤に対する治療反応性不良の状況(あり/なし)、ベースラインのステロイド系薬剤の使用(あり/なし)、ベースラインの疾患活動性(MMS 4~6/7~9)を調整因子としたCMH法
- b 投与群、ベースライン値、時期、ベースライン値と時期の交互作用、投与群と時期の交互作用、生物学的製剤に対する治療反応性不良の状況(あり/なし)、ベースラインのステロイド系薬剤の使用(あり/なし)、ベースラインの疾患活動性(MMS 4~6/7~9)を説明変数とした繰り返し測定値に関するMMRM
欠測値の補完方法:・単一の時点でのデータ欠損の場合、mBOCF法を用いて補完 ・有害事象で投与を中止した場合、ベースラインの値を用いて補完 ・有害事象以外の理由で投与を中止した場合、得られた最終観測データを用いて補完
評価項目の用語の定義についてはLUCENT-1試験の概要参照
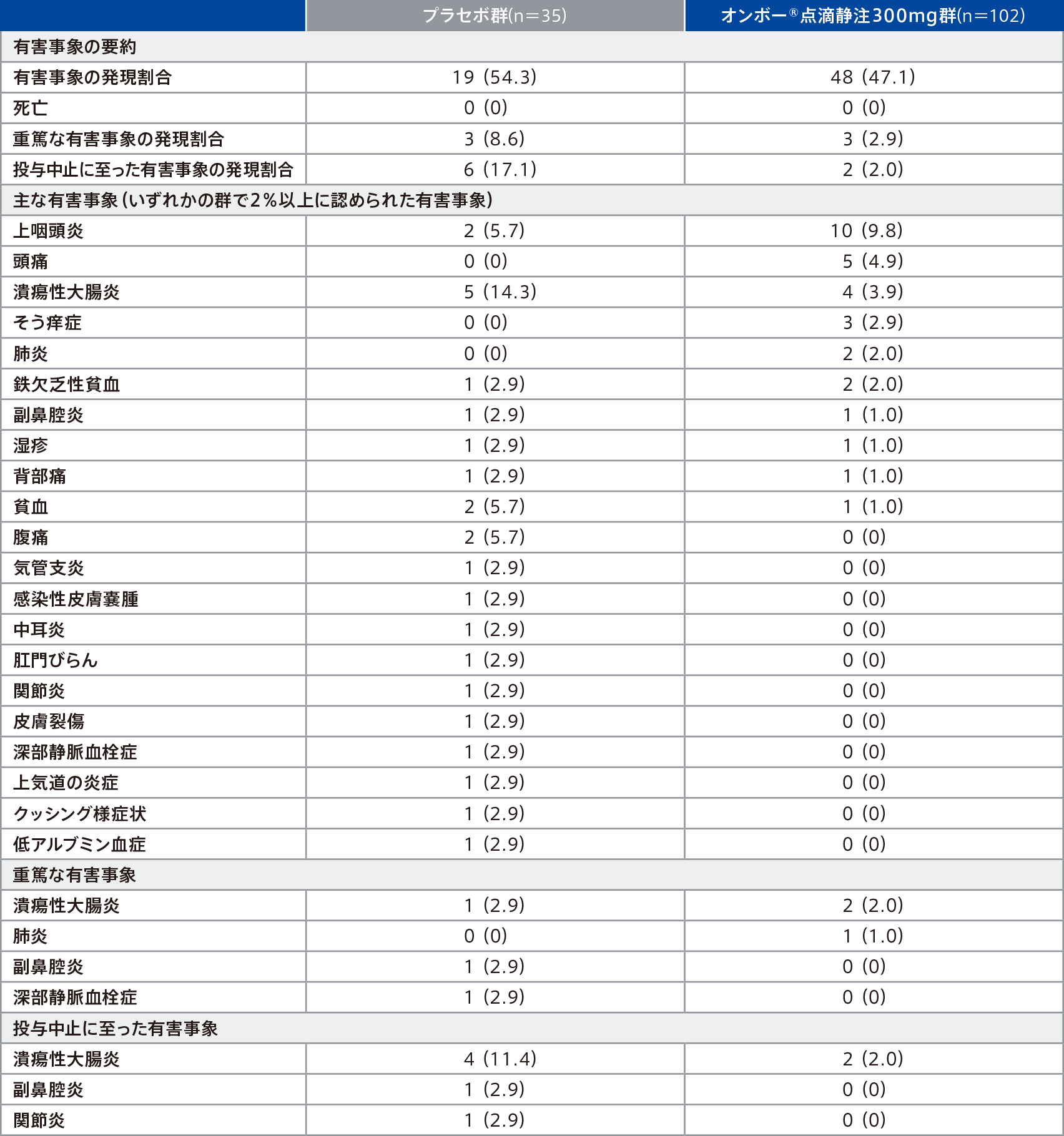
安全性
寛解導入期での有害事象は、プラセボ群54.3%(19/35例)、オンボー®点滴静注300mg群47.1%(48/102例)に認められ、主な有害事象(いずれかの群で2%以上に認められた有害事象)は下表のとおりであった。
因果関係が否定できない有害事象は、プラセボ群5.7%(2/35例)、オンボー®点滴静注300mg群9.8%(10/102例)に認められ、2%以上に認められた因果関係が否定できない有害事象は、プラセボ群では副鼻腔炎2.9%(1/35例)、潰瘍性大腸炎2.9%(1/35例)、オンボー®点滴静注300mg群では頭痛2.9%(3/102例)、そう痒症2.0%(2/102例)であった。
本試験において死亡は認められなかった。
重篤な有害事象は、プラセボ群8.6%(3/35例)、オンボー®点滴静注300mg群2.9%(3/102例)に認められ、その事象は下表のとおりであった。このうち、プラセボ群の副鼻腔炎1例、オンボー®点滴静注300mg群の潰瘍性大腸炎1例は、治験薬との因果関係ありと判断された。
投与中止に至った有害事象は、プラセボ群17.1%(6/35例、潰瘍性大腸炎4例、副鼻腔炎1例、関節炎1例)、オンボー®点滴静注300mg群2.0%(2/102例、潰瘍性大腸炎2例)に認められた。